07 人類基因組:生命的腳本
聚合酶連鎖反應是在西特斯公司服務的穆利斯(Kary Mullis)發明的。根據他的說法,「1983年4月一個星期五晚上,我手握車子方向盤,沿著蜿蜒山路開往加州北部的紅杉區,就在那時,我突然有了這個構想。」在那種危險的情況中,他居然還能產生靈感,實在很神奇。倒不是因為加州北部的路特別危險,而是就像他的一位朋友告訴《紐約時報》的:「穆利斯曾在一個幻像中看到自己因頭部撞到紅杉而死,所以只要在沒有紅杉的地方,他總是一無所懼。這位朋友曾經在滑雪勝地阿斯彭(Aspen)看到穆利斯腳踩滑雪板,穿梭在快速的雙向車陣,神勇地從結冰的道路中央疾滑而下。穆利斯因他的發明在1993年榮獲諾貝爾化學獎,從此以後他變得更加古怪。他支持修正派的理論,認為艾滋病不是HIV所引起的,這使他的可信度和推動公共衛生的努力都打了折扣。
讓人類基因組計劃邁出第二步的推手,也令人感到意外:美國能源部(DOE)。它的任務當然是以美國的能源需求為主,但是其中至少有一項任務與生物有關:評估核能對健康的危害。因此,能源部一直都有提撥經費,追蹤長崎和廣島原子彈爆炸事件的倖存者及其後代,研究他們遺傳基因受到的長期損害。還有什麼比人類基因組的完整參考序列更適合用來確認輻射造成的突變?1985年秋天,能源部主管健康與環境研究的德利西(Charles DeLisi)召開了一個會議,討論能源部的基因組計劃。生物界人士充其量也是抱著懷疑態度,斯坦福遺傳學家波茲坦(David Botstein)譴責這個計劃是「能源部為失業的炸彈製造者所做的計劃」,當時的國家衛生研究院院長溫嘉丹(James Wyngaarden)則將這個構想比喻為「國家標準局提議建造B-2隱形轟炸機」(難怪國家衛生研究院後來會成為人類基因組計劃最耀眼的一員)。然而,能源部在整個計劃中仍扮演了重要角色,根據最後的統計,大約11%的定序工作是由它負責。
在了解其中的利害關係后,你可能會認為支持人類基因組DNA定序計劃,就像要人支持媽媽和蘋果派一樣,不會有多少爭議。有哪個腦筋清醒的人會反對?然而,在20世紀80年代中期,學者專家首度開始討論基因組定序的可能性時,仍然有人認為這是不太可能實現的構想,有些人則認為這個構想的野心大得不像話,就像跟維多利亞女王時代的熱氣球駕駛人建議要送人上月球一樣。
然而這個快速馬虎的做法無法取代破解整個基因組。我們現在已經知道,基因組最有趣的部分有許多是位於基因以外,它們構成控制基因啟閉的機制。以剛才腦組織的cDNA分析為例,你只能對在腦部是開啟的基因有概略的了解,但是對它們的啟動過程毫無概念:將DNA股複製至信使RNA的RNA聚合酶,並不會把DNA中極重要的調節區段轉錄到RNA上。
從一開始,我就認為人類基因組計劃無法通過無數的「小工作」來完成,亦即無法在過多實驗室的參与下完成。整個後勤作業會太過混亂,也無法獲得規模化與自動化的好處。因此,華盛頓大學、斯坦福大學和加州大學舊金山分校、密歇根大學安娜堡分校、劍橋的麻省理工學院,以及休斯敦的貝勒醫學院(Baylor College of Medicine)很早就成基因圖譜中心。能源部的工作最初集中在濟斯阿拉莫斯(Los Alamos)和利弗莫爾(Livermore)國家實驗室,最終都移到了加州的沃爾納特克里克市(Walnut Creek)。

聚合酶連鎖反應(PCR)發明人穆利斯和他的衝浪板
我們估計整個計劃大約費時15年,成本每年約2億美元。我們做了更多複雜的計算,但都脫離不了吉爾伯特每個鹼基對1美元的估算。每發射一次太空梭耗資4.7億美元,基因組計劃的費用相當於發射六次太空梭。
基因攸關我們生命中每一個成功與不幸,甚至我們最終的命運。它們與所有的死亡原因多少都有些關係,只與意外事故無關。纖維囊泡症和泰賽二氏症(Tay-Sachs)等直接由基因突變引起的疾病,是最明顯的例子之一。但是還有許多其他的基因,同樣攸關生死,只不過運作方式比較迂迴,它們會讓我們容易罹患常見的殺手疾病,像是癌症和心臟病,這兩種病可能會在家族裡遺傳。甚至我們對麻疹和普通感冒等傳染性疾病的反應,也與基因有關,因為免疫系統是由我們的DNA所控制的。老化基本上也是一種基因現象:變老所呈現的一些表現,多少反映出我們的基因在一生中所累積的突變。因此,如果要徹底了解這些攸關生死的遺傳因子,並最終能處理與它們有關的問題,就必須編出一份我們身體里所有遺傳因子的清單。
正當人類基因組計劃熱烈展開之際,有關執行它的最佳方法也爭論不斷。有些人指出,人類基因組中有一大部分是我們這一行謔稱的「垃圾」,也就是顯然不負責任何編碼工作的DNA片段。事實上那些為蛋白質編碼的片段(亦即基因)僅占整個基因組的一小部分。有些批評者詰問道:既然如此,我們為什麼要定序整個基因組,為什麼要耗費心力去管那些「垃圾」?其實有一種極度快速但馬虎的方式可以替基因組裡所有編碼基因拍張「快照」,方法是利用本書第五章描述過的反轉錄酶。從任意一種類型的組織中純化出信使RNA樣本;如果你的來源是腦,就會得到腦部所有表現型基因的RNA樣本。然後你可以利用反轉錄酶製造這些基因的DNA複本(稱為互補DNA,cDNA),然後定序這些cDNA。

2000年6月26日:草圖在握的溫特(左)和柯林斯暫時放下敵對意識,跟總統一起成為矚目焦點。
即使在所謂的G5當中,蘭德的實驗室對DNA序列的貢獻也是最大的。G5指基因組公共計劃的五大中心——蘭德的實驗室、桑格中心、華盛頓大學的基因組定序中心、貝勒醫學院和美國能源部在沃爾納特克里克的實驗室。他的麻省理工小組也是在促成基因組草圖問世的最後衝刺階段,大幅提高生產力的大功臣。1999年11月17日,人類基因組計劃慶祝定序第十億個鹼基,那是一個G。短短四個月後,也就是2000年3月9日,T成為第二十億個被定序的鹼基。G5加足了馬力。因為賽雷拉基因公司在使用公共計劃的數據,這些數據總是在被發現后立即上網,現在公布的數據又多又快,可以借力使力的溫特或許終於決定可以鬆懈一下,把賽雷拉原本預定要做的定序數量減半。
然而,正當人類基因組計劃的國際團隊開始定序模型生物,準備全力朝最終目標前進時,分子生物界的一場大地震卻撼動了整個計劃。
在經費短缺的英國醫療研究委的會任職的布雷納,率光採取以eDNA為主的方法,大規模地發現基因。他認為定序cDNA,是在只有少數經費時,最符合成本效益的方法。由於渴望從這些序列獲取商業利益,英國的醫學研究委員會不準布雷納發表成果,直到英國製藥商準備好從中獲利后,才讓他發表。
在那段早期歲月,吉爾伯特是支持人類基因組計劃最有力的人士。他貼切地指出,這「在調查人類功能的各個層面上,是一個無與倫比的工具」。在協助成立Biogen生技公司、嘗過科學與商業結合的刺|激滋味后,他在基因組上看到了嶄新的大好商機。因此在短暫任期后,他就把在這個委員會的職位轉讓給華盛頓大學的奧森(Maynard Olson),以迴避任何可能的利益衝突。分子生物學已經證明具有創造龐大商機的潛力,而吉爾伯特認為沒有必要再籌措公共資金。他推論,只要擁有大型定序實驗室,私人公司就可以做這個工作,然後把基因組的信息賣給製藥廠和其他利益團體。1987年春天,吉爾伯特宣布籌組「基因組公司」(Genome Corporation)的計劃。當時對於私人擁有基因組數據的可能性,有許多強烈不滿的聲音(大家擔憂這會讓新知識不能廣為利用、造福大眾),但吉爾伯特對這些充耳不聞,開始籌措風險投資資金。只可惜,他因為過去擔任執行長的紀錄不佳而出師不捷。自從他在1982年辭掉哈佛的教職,擔任Biogen的總裁后,這家公司立即在1983年虧損1160萬美元,後來又在1984年虧損1300萬美元。他會在1984年12月回到哈佛,躲到覆滿常春藤的校牆后,也是可以理解的,不過Biogen在他離開后仍不斷賠錢。吉爾伯特的新計劃算不上是令人垂涎三尺的投資案,但最終這個野心勃勃的計劃之所以失敗,與其說是經營管理能力的缺失,不如說是非他所能控制的大環境所致:1987年10月美國股市大崩盤,基因組公司的成立計劃也隨之崩解。
其實,吉爾伯特惟一犯的錯就是超前他的時代。在他的成立計劃胎死腹中整整10年後才成立的賽雷拉基因公司(Celera Genomics),在規劃上跟吉爾伯特的構想大同小異,但賽雷拉基因公司卻相當成功。吉爾伯特的風險投資事業引發外界對DNA序列數據可能為私人擁有九*九*藏*書的疑慮,而隨著人類基因組計劃的進展,這些疑慮也逐漸成為矚目焦點。
乍看之下,薩爾斯頓似乎不適合在「大科學」中擔任領導人。他大半職業生涯都花在用顯微鏡來觀察線蟲上,以便能一個細胞一個細胞地精確描述線蟲每一個發育過程。他是英國國教牧師之子,留了一臉鬍子,像個老伯伯。他一生支持社會主義,篤信商業與人類基因組毫無關係。如同柯林斯,他也是機車迷,以前經常騎著他那輛的機車往返於他位於劍橋外的家和桑格中心之間,一直到他在車禍中受了重傷,而他的機車也變成他口中「比螺釘和螺帽多不了多少」的廢鐵后,他才停止這麼做。當時正值人類基因組計劃逐漸加快腳步之際,車禍發生后,贊助桑格中心的維康信託基金會才驚恐地得知,原來這個計劃的科學領導人每次上班都在冒生命危險。基金會董事長奧吉維(Bridget Ogilvie)說:「虧我們在這傢伙身上投資了這麼多錢!」
基因組計劃的國際合作模式也是在早期階段就已奠定:由美國主導這項計劃並執行超過半數的工作;其餘的部分主要由英、法、德、日負責。儘管英國的研究委員會(Medical Research Council)多年來致力遺傳與分子生物學的研究,但在這項計劃上貢獻並不多。它和英國的整體科學一樣,都受到撒切爾夫人缺乏遠見的經費緊縮政策影響。幸好民間的生物醫學組織維康信託基金會(Wellcome Trust)伸出援手;1992年,維康在劍橋外特別成立一所定序機構,並命名為桑格中心。在國際合作方面,我決定把基因組依照不同的部分分配給各個國家。以這樣的方式,參与國應該會感到自己有具體的努力目標,例如特定染色體的一臂,而不是跟一群無名的克隆株苦苦奮鬥,比如日本的重點主要是第21號染色體。遺憾的是,為了儘快完成整個工作,最後仍無法按這個條理來做,結果證明:要把基因組圖譜按世界地圖分配,畢竟太過困難。
對那些直接負責建立人類基因組圖譜的人(波上頓、艾奧瓦州、猶他州和法國的研究小組)來說,最重要的頭幾步是找出基因標誌(genetic marker):兩個人染色體上的同一段DNA會有一個或一個以上的鹼基對不同,這些不同的位點即稱做基因標誌(亦稱遺傳標誌),它們可以作為地標,引導我們破解整個基因組。在柯恩(Daniel Cohen)和魏森巴赫(Jean Weissenbach)的領導下,法國的Cénéthon研究所很快就建立起極好的圖譜;Cénéthon是由法國肌肉萎縮症協會贊助的、類似工廠的基因組研究機構。如同英吉利海峽對岸的維康信託基金會,這家法國慈善機構彌補了政府贊助不足所留下的部分經費缺口。在最後的衝刺階段,必須利用BAC來建立詳細的實質圖譜時,麥克弗森(John McPherson)在華盛頓大學基因組中心所領導的計劃貢獻最大。
國家科學院委員會仍在商議時,我到參眾兩院審查國家衛生研究院預算的衛生小組委員會,跟他們的重要成員會談。國家衛生研究院的院長溫嘉丹支持基因組計劃,而且根據他的說法是「從一開始」就支持,但是國衛院里眼光較為短淺的人士卻表示反對。我在建議以3000萬美元讓國衛院參与基因組研究時,特彆強調基因組序列的知識對醫學的影響。國會議員跟我們其他人一樣,也會有摯愛的人因為癌症等與基因有關的病症去世,應該也可以體會,解開人類基因組序列能夠協助我們對抗這類疾病。最後,我們獲得1800萬美元。
溫特和黑索廷搶著替他們用cDNA定序法找到的每一個人類基因申請專利,這當中極少牽涉到技術或創新發明。他們這兩家生技公司,就像霸佔遊戲場里所有玩具,不讓別人玩的孩子一樣。
到了1986年,談論基因組的聲音愈來愈大。6月,我在冷泉港實驗室一個重要的人類遺傳學會議期間,安排了一場特別會議來討論這個計劃。前一年曾在加州參与辛謝默那場會議的吉爾伯特一鳴驚人,提出一個可怕的成本預估數字:30億鹼基對,30億美元!這的確是一個要花大錢的科學計劃。如果沒有公共資助,這筆錢多得難以想像,會議中自然有人會擔心,這個成敗未卜的龐大計劃會搶走其他一些重要研究的經費。他們擔心人類基因組計劃會成為科學研究最大的錢坑。就科學家個人對事業的企圖心而言,做這個計劃再怎麼樣也不划算。人類基因組計劃在技術上當然有許多挑戰,但它在智識層面並不能讓人感到非常振奮或能帶來多少名聲。這整個工作實在非常龐大,即使是很重要的突破也會被淹沒;再說,有誰願意把自己的一生花在永無止盡、冗長無聊的定序工作上?波茲坦就提醒大家要非常謹慎:「這會改變科學的結構,使我們所有人,尤其是年輕人,都被這個龐大的工作綁住,就像太空梭一樣。」
當公共與私人機構的競賽在媒體的戰場上達到高峰時,在後方,備戰的焦點已逐漸轉移到數學智庫上,也就是隱身在密室中一排排計算機后的科學家。他們得設法解開所有這些A,T,G,C的原始序列。他們的任務主要有兩項。第一,把手上許多分散的片段組合成完整的、確定的序列。大多數的部分都已經被定序了無數次,所以他們等於是要理清包含數個基因組的序列,而且得去蕪存菁,直到只剩下一個標準的基因組序列。這是相當龐大的計算工作。第二,辨識最後序列中的成分,尤其是基因的位置。要確認基因組的成分(分辨這些由A,T,G,C構成的片段,哪些編碼垃圾,哪些編碼蛋白質),必須靠極度密集的計算機運算才能達成。
美國基因組研究所、人類基因組科學公司和史克必成製藥公司三雄鼎立,在未來有可能壟斷人類基因序列的商業運用,這情形讓分子生物產學兩界都產生警覺。1994年,史克必成在製藥業中的老對頭默克公司(Merck)了提供1000萬美元讓華盛頓大學的基因組中心定序人類cDNA,並公開發表研究結果,給了人類基因組科學公司一巴掌。
人類基因組計劃是一項了不起的科技成就。如果在1953年時有人說,整個人類基因組會在50年內定序,克里克和我一定會大笑,請他再喝一杯酒。過了20多年,首批DNA定序法終於問世時,這種懷疑似乎仍很合理。這些方法當然都是技術上的突破,但當時定序過程仍極度緩慢(即使要定序長度只有數百個鹼基對的基因,都是一項重大挑戰)。如今,在僅僅又過了25個年頭后,我們已經在慶祝完成大約31億個鹼基對的序列了。然而我們仍然必須牢記,雖然基因組定序是驚人的成就,但它絕不只是一個科技上的里程碑而已。不論直接的政治動機為何,柯林頓在白宮慶祝會上說得很對:我們手中可能已經握有對抗疾病的強大新武器。而且,我們甚至可能對生物的組成與運作,以及我們和其他物種之間的差異有全新的了解,亦即洞察我們之所以為人的道理。
PCR立即成為人類基因組計劃的主要「累活」。現在的過程跟穆利斯當初所發展的大致相同,只不過已經自動化。今日最先進的實驗室都有由機器人控制的生產線,不再需要睡眼惺忪的研究生軍團來執行把微量液體加入塑料管的辛苦工作。在基因組定序這種規模的計劃中,這些「PCR機器人」必須使用大量聚合酶。因此,人類基因組計劃的科學家對必須支付大筆不合理的權利金給PCR專利所有人羅氏製藥廠,導致聚合酶的成本增加,感到特別厭惡。
同時,我們應把重點放在儘可能建立精確的基因組圖譜上,而且基因圖譜與實質圖譜都要建立。基因圖譜(genetic mapping)決定相對位置,也就是染色體上基因地標(genetic landmark)的順序,如同「摩根的孩子們」最初對果蠅染色體所作的研究。實質圖譜(physical mapping)則是實際確認這些基因地標在染色體上的絕對位置。(基因圖譜告訴我們,二號基因位於一號和三號基因之間;實質圖譜告訴我們二號基因距離一號基因一百萬個鹼基對,而三號基因是在染色體上再往後兩百萬個鹼基對的地方。)基因圖譜呈現出基因組的基本結構;實質圖譜則可以提供定序儀(sequencer)染色體上的定位錨,然後我們便可以藉由參照這些定位錨,決定各個序列片段在染色體上的位置。
辛謝默是分子生物學家,非常渴望他的領域也能躋身經費龐大的科學「大聯盟」。物理學家有昂貴的超級碰撞加速器,天文學家有7500萬美元的望遠鏡和人造衛星,為什麼生物學家不能有高檔昂貴的計劃?於是他建議聖克魯斯大學成立一家研究所,專門為人類基因組定序;1985年5月,一項會議在聖克魯斯召開,討論辛謝默的構想。整體而言,與會者認為這個計劃野心太大,但同意初期的研究重點應放在對醫學具有重要意義的特定基因組領域。最後這場會議卻毫無成果,因為霍夫曼的錢並未進入加州大學的財庫。但是聖克魯斯這場會議仍播下了種子。
在20世紀70年代,黑索廷是哈佛的研究生,由我和吉爾伯特共同指導。後來他在醫學院的達納—法伯癌症研究中心(Dana Farber Cancer Center)管理一個創新的HIV研究中心。但一直到和身價不菲的社交界名媛海曼(Gale Hayman,80年代人人搶著擁有的香水品牌Giorgio Beverly Hills的創造者)結婚後,他才獲得高知名度,所以他在成立人類基因組科學read.99csw.com公司時,銀行存款絕對不只2000美元。他在成為企業家之前,就曾因搭乘噴氣式飛機四處旅行,引來哈佛醫學院實驗室同事的非議和譏諷。「黑索廷和上帝的差別在哪裡?」答案:「上帝無所不在,黑索廷也無所不在,就只不在他應該在的波士頓。」
但是全基因組隨機定序法是否適用於大型複雜的基因組,例如人類基因組,則尚未獲得證實。問題在於重複,亦即相同序列的片段會在基因組的不同位置發生,基本上,這些重複有可能使全基因組隨機定序法無法成功,也很有可能誤導最精密的計算機演算。舉例來說,如果有一個重複片段發生在A片段和P片段內,計算機有可能誤把A排在Q旁,而不是它原本應在的位置,即B的旁邊。人類基因組計劃的研究小組在考慮採取全基因組隨機定序法時,也討論過這個可能性,而根據西雅圖的葛林(Phil Green)的精密計算,這個小組的結論是:由於人類基因組有垃圾DNA這些大量冗長的重複序列,所以這個方法可能會造成混淆。
儘管反應並不怎麼熱烈,但那次冷泉港的會議卻讓我堅信,為人類基因組定序勢必很快會成為國際科學界的優先要務,而當這成真時,國家衛生研究院應該擔任一個主要的角色。我說服了麥克道爾基金會James S. McDonnell Foundation),請他們贊助一項由國家科學院(NAS)所主持的對相關議題的深入研究。由於有加州大學舊金山分校的艾爾伯特(Bruce Alberts)擔任委員會的主席,我確信所有的構想都會受到最嚴格的監督。前不久艾爾伯特才發表一篇文章,警告「大科學」的興起,勢將排擠世界各地的個別實驗室在傳統研究上的無數創新貢獻。在不確定我們的小組會達成什麼意見之前,我已經和吉爾伯特、布雷納和波茲坦加入了15人的委員會;翌年(1987)我們便努力規劃出未來的基因組計劃細節。

薩爾斯頓在美國的合作夥伴瓦特斯頓出身普林斯頓大學,主修工程學。他為自己管理的華盛頓大學大型定序中心引入了許多工程學智慧。瓦特斯頓具備從己知事物推測未知事物的能力,也就是可以從小事開始,完成大事。他在陪女兒慢跑時發現自己很喜歡跑步,現在他己是馬拉松好手。他的定序小組在第一年時,只找出了線蟲序列的4萬個鹼基對,但是在數年之內,他們的成果便巨量增加,瓦特斯頓也是最早呼籲全面展開人類基因組定序工作的人士之一。

催生人類基因組計劃:1986年,大力支持這項計劃的哈佛大學教授吉爾伯特(左)和斯坦福大學的波茲坦在冷泉港實驗室爭論的情景。
帶領各國的定序中心度過最後障礙的功臣之一,是出身美國中西部、作風豪邁的威爾遜(Rick Wilson),他繼瓦特斯頓之後成為華盛頓大學基因組研究中心的主任。這場遊戲的名稱叫做「質量控制」,每條染色體都由一位協調人負責,他們必須監督進展,確保自己負責的對象符合這個計劃的整體規定。在定序過程中偶爾會有問題發生(例如一條稻米序列莫名其妙地混入要送至資料庫的數據中),但篩檢程序證明可以有效地排除這種污染。在我撰寫本書時,人類基因組計劃正朝2003年4月前完成「基本上完整」的序列前進,也是雙螺旋體發表50周年。
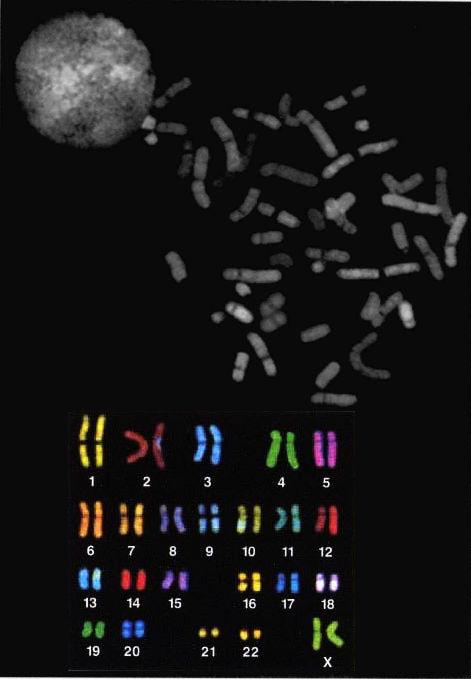
以染色體專用熒光著色劑上色的整套人類染色體。每個細胞里的染色體總數是46個——完整的兩套,各從父方和母方得到一套。基因組是一套23個染色體,亦即23個很長的DNA分子。

國際合作:英國和美國的科學家率先完成第一個複雜生物(線蟲)的基因組定序工作;這個計劃的主持人瓦特斯頓(圖左)和薩爾斯頓仍會找時間輕鬆一下。
溫特和美國基因組研究所一直進行得很順利。在運用cDNA基因發現策略數年後,溫特開始對整個基因組的定序產生興趣。在這一點上,他仍很相信自己那套方法的優越性。人類基因組計劃是先仔細地建立DNA不同片段的位置,然後才開始實際的定序工作。這樣的話,我們事先已經知道A片段位於B片段旁,等到要把它們連成最後的序列時,便可以找出它們之間的重疊部分。但溫特偏好「全基因組隨機」(whole genome shotgun, WGS;亦稱「全基因組散彈槍」)定序法,這種方法不做初期的圖譜建立工作,而是直接把基因組隨機分成一個個片段,找出它們的序列,然後把這些序列全部輸入計算機,靠計算機按照重疊部分把它們排成正確的順序,並不藉助預先定好位的信息。溫特和他的團隊證明這種蠻幹的做法實際可行,至少可用於破解簡單的基因組:1995年,他們發表了用這方法找出的流感嗜血桿菌(Haemophilus influenzae)基因組序列。
其實,DNA自動化定序是史密斯(Lloyd Smith)和杭卡皮勒(Mike Hunkapiller)的構想。當時在胡德實驗室工作的杭卡皮勒去找史密斯談一種定序法,想對每種鹼基使用不同的有色染劑。原則上,這個構想可以使桑格定序法的效率提高四倍:先前的方法要分別做四次定序反應,每次各使用一條凝膠;但採用顏色代碼后,只須做一次定序反應,總共只需要一條凝膠。起初史密斯的反應很悲觀,擔心這個方法使用的染劑量太少,無法偵測。但他不愧是激光應用專家,很快就想到解決辦法,亦即採用在激光下會發出熒光的特殊染劑。
按照標準的桑格定序法,不同大小的DNA片段會在凝膠中按大小排列,每個片段都用與其末端的雙脫氧核苷酸相對應的熒光染劑加上標誌,該片段發出的顏色就可以顯示它具有哪個鹼基。然後再以激光掃過膠體底部,讓每個片段發出熒光,這時電眼會偵查每個DNA片段發出的顏色,接著這個信息會直接輸入計算機,省去了麻煩的人工輸入數據過程。杭卡皮勒在1983年離開胡德的實驗室,加入新成立的儀器製造商——應用生物系統公司(Applied Biosystems Inc.,ABI)。後來率先製造出商用史密斯-杭卡皮勒定序儀的,就是這家公司。從此以後,定序過程的效率大幅改善:笨拙緩慢的膠體被高效能的毛細管系統取代,細長的毛細管可以非常快速地將DNA片段按大小分類。這家公司目前最新一代的定序儀速度更是超快,比原型快上千倍。它們所需的人工極少(每24小時大約只需15分鐘的人工),一天就可以定序50萬個鹼基對。最終就是因為有這項技術,基因組計劃才得以實行。
溫特發現替基因組的片段申請專利,可能帶來許多商業機會後,在這方面的胃口大開。但他想魚與熊掌兼得:繼續留在可自由分享信息但薪水很少的學術圈,同時進入商業圈,在取得專利權並賺上一票之前,他的發現將是秘密。在像是他的教父的風險投資家斯坦伯格(Wallace Steinberg)協助下,溫特的夢想終於在1992年成真。斯坦伯格是麗奇(Reach)牙刷的發明人,他提供7000萬美元成立了兩家機構。一家是非營利事業,基因組研究所(The Institute for Genome Research, TIGR,英文發音與tiger[老虎]相同),由溫特主持另一家姐妹公司是人類基因組科學公司(Human Genome Sciences, HGS),由商業傾向的分子生物學家黑索廷(William Haseltine)領導。它們的運作方式是:基因組研究所研究引擎,負責挖掘出cDNA序列;人類基因組科學公司走商業路線,負責營銷這些發現。在前者發表數據前,後者會有六個月時間評估這些數據,但在研究顯示它們有發展新葯的潛力時,評估時間則延長為一年。
他名叫肯特(Jim Kent),長得有點像「感恩而死」(Grateful Dead)搖滾樂團的一個成員。從進入個人計算機時代以來,他就一直在為計算機製圖和動畫撰寫程序,但後來他決定念研究生,投身生物信息學(bioinfor-matics),亦即致力於分析DNA與蛋白質序列的新領域。有一天他在收到微軟寄給Windows95程序開發人員的整整12張CD-ROM時,決定不再做商業程序設計:「我心想整個人類基因組可能只需要一張CD-ROM就夠了,而且不必每3個月就更新一次。」到了5月時,他自信已經想出一個好方法,可以解開大家都在談論的組合問題,於是他說服校方把剛為教學購置的100台個人計算機「借給」他。然後他展開為期四周的程序設計馬拉松,晚上還冰敷手腕,以免白天編寫大量程序read.99csw.com代碼時,手腕會變得僵硬。他的最後期限是6月26日,那也是預定宣布完成基因組草圖的日期。他終於寫好程序,讓100台計算機開始運作,結果在6月22日,他的百台計算機大軍成功解決了組合問題。賽雷拉的邁爾斯甚至到更接近底限的6月25日晚上才完成。
吉爾伯特離開后,我們的國家科學院委員會在艾爾伯特的領導下,規劃出一個在當時來講很合理的計劃,事實上,人類基因組計劃多少是根據這些規劃來執行的。我們預測的成本及時程後來也證明相當準。擁有個人計算機的人都知道,科技會隨著時間變得更好、更便宜,因此我們建議把大部分實際的定序工作延後,直到技術的成本效益達到合理程度時再開始,並把改善定序技術列為優先事項。為了達到這個目標,我們建議先找出較簡單生物的基因組序列(它們的基因組比較小)。從中獲得的知識本身就很有價值(可以在最終找出人類基因組序列后拿來作比較,得到許多啟發),同時也可以藉此精進我們的定序技術,供其後解開龐大基因組之用。非人類研究目標的不二之選自然是遺傳學家的舊愛:大腸桿菌、酵母菌、線蟲(學名C. elegans,它在布雷納帶動下成為研究寵兒),以及果蠅。
人體複雜得令人迷惑。傳統上,生物學都是專註於一小部分,試圖詳盡地了解它。在分子生物學來臨后,這個基本做法仍然沒有改變。科學家大多仍只擅長一個基因,或涉及某條生化路徑的一群基因。但任何機器的零件都無法獨自運作。如果我要研究轎車引擎的化油器,就算是把它研究徹底,我還是無法了解引擎的全部功能,更不用說整輛車要了解引擎的功能及運作原理,我必須研究整台引擎才行。我得把化油器放進引擎運作的整體架構內,當做一個發揮功用的零件,就跟許多其他的零件一樣。基因的情況也一樣。若要了解決定生命的遺傳過程,我們不僅必須對個別的基因或路徑有詳細的知識,也需要把這些知識放進整個系統,也就是「基因組」的架構里去看。
在白宮的大肆宣揚下,人們很容易忽略這場慶祝的對象只是人類基因組的「草圖」而已,還有許多工作尚待完成。其實稱得上完整並已發表的序列,也只有最小的兩條染色體(第21和22號染色體)而已,何況就連它們也不敢說是百分之百完整無缺。至於其他的染色體序列,有些都是空隙。自從那場隆重的宣布后,大家的目光已經放在2003年4月的新期限上,要在這個日期前填補好這些缺口,提出完整、正確的序列。然而後來證明,有些小區域根本無法定序,而實際目標也變成找出「基本上完整」的序列:至少完成95%的序列,而且誤差率在萬分之一個鹼基以下。
我的工作是要向國會爭取更多經費,同時確保這些經費都運用得當。我最關心的事情之一,是人類基因組計劃的預算能跟國家衛生研究院其他計劃的預算分開。人類基因組計劃不能危及其他科學的生存;如果我們的成功會讓其他科學家理直氣壯地說,他們的研究成為這個龐大計劃的犧牲品,我們就沒有成功的權利。同時,我也認為,身為推動這項創舉的科學家,我們應該顯示出,我們了解它的深遠影響。人類基因組計劃不僅是定出A,T,G,C的位置,在各個層面上,它都是人類所能獲得最珍貴的知識之一,甚至可能回答與人性有關的最基本的哲學問題。我決定我們應該把總預算的3%(這比例雖然不高,金額卻很龐大)用於研究這個計劃對道德、法律與社會的影響。後來在參議員戈爾(Al Gore,其後曾出任副總統)的敦促下,這個比例提高至5%。
DNA定序法本身也是另一個「累活」。同樣地,這個方法的化學原理並非新發明:人類基因組計劃使用的方法,和桑格在70年代中期發明的相同,其創新之處在於通過定序機械化,來達到大規模操作的目的。
接下來要做的事是研究和發展替代性的定序技術,希望能把整體成本減至每個鹼基對50美分左右。我們展開了數個試行計劃,諷刺的是,最後很成功的熒光染劑自動定序法(fluorescent dye-based automated sequencing)在這個階段的進展並不特別好。事後回顧,自動化機器定序的試驗工作,應該交由國家衛生研究院的研究員溫特(Craig Venter)來做,當時他已經證明是箇中好手。他曾提出申請,但最後獲選的人是這項技術的原始發明人胡德(Lee Hood)。未聘用溫特一事,到後來造成了很大的影響。
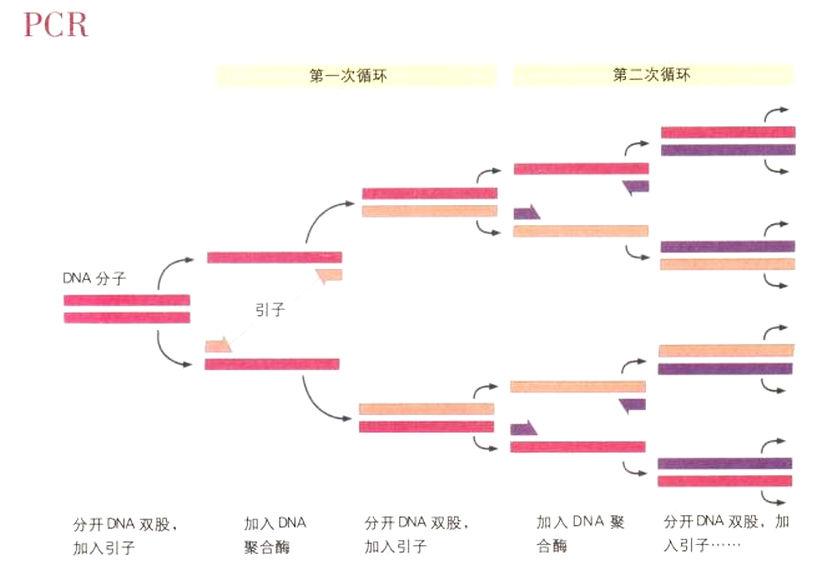
擴增目標DNA片段:聚合酶連鎖反應
再也想不到的是,結果竟然是一個望遠鏡在偶然間促成了「人類基因組計劃」(Human Genome Project, HGP)。在80年代初,加州大學的天文學家提議興建世界最大、功能最強的望遠鏡,成本預計在7500萬美元左右。當霍夫曼基金會(Max Hoffman Foundation)承諾贊助3600萬美元時,加州大學感激地同意以這位慷慨贊助人之名來替這個計劃命名。只可惜這種感謝方式反而讓剩餘經費的籌措事宜變得複雜起來。其他的募款對象不願意提供經費,興建一個已經以他人之名命名的望遠鏡,這個計劃就此進退不得。最後,另一個更富有的慈善機構凱克基金會(W. M.Keck Foimdation)介入,表示願意贊助這項計劃的所有費用。加州大學很高興地接受,無論有沒有霍夫曼的支持都一樣。(新的凱克望遠鏡建於夏威夷的冒納凱阿山[Mauna Kea]山頂,於1993年5月全面啟用。)霍夫曼基金會不願屈居凱克基金會之下,於是撤回資金,這時加州大學的行政主管察覺到這是一個3600萬美元的機會,特別是加州大學聖克魯斯分校的校長辛謝默(Robert Sinsheimer),他知道霍夫曼基金會的錢足以支持一項重要的研究計劃,而這將足以「讓聖克魯斯揚名於世」。
大約在溫特和黑索廷的公司開始把基因組商業化時,柯林斯(Francis Collins)繼我之後出任國家衛生研究院的基因組研究中心主任。柯林斯是最佳人選,他是建立基因圖譜的一把好手,在數個重大疾病的基因方面經驗豐富,包括與纖維囊泡症、纖維神經瘤病(neurofibromatosis,即所謂的「象人」病)和亨廷頓氏症有關的基因。如果有人頒發人類基因組錦標賽初賽(以建立重要基因的圖譜及找出其特徵為目標)的獎項,柯林斯無疑會是大贏家。但是他自有記分方式:他最愛的交通工具是本田的夜鷹機車,每次他的實驗室又建立一個新基因的圖譜時,他的同事都會在他的安全帽上加一個印花圖案。
蘭德在純數學圈子裡,顯得格外喜歡社交,最後他終於發現純數學是「孤立、類似修道生活的領域」,於是加入比較有趣的哈佛商學院去任教,但他很快就發現自己對神經科學家弟弟的工作產生興趣。在受到啟發后,他晚上到哈佛和麻省理工的生物系進修,但白天在商學院的工作仍處理得好好的:「我幾乎是在街角就把分子生物學念起來的,不過這裡有很多非常好的街角可以讓你私下學習。」麻省理工的懷特海德研究所就是這些街角之一,而蘭德也在1989年成為該所的生物學教授。

在白宮外:(左起)沃森、蘭德(麻省理工懷特海德研究所)、吉布斯(Richard Gibbs,休斯敦貝勒醫學院)、瓦特斯頓(聖路易華盛頓大學)和威爾遜(聖路易華盛頓大學)合影
在賽雷拉基因公司負責計算機運作的人是邁爾斯(Gene Myers),這位計算機科學家是率先全力支持全基因組隨機定序法的人。早在賽雷拉公司還沒成立前,他和威斯康辛州馬什菲爾德研究基金會(Marshfield Research Foundation)的韋伯(James Weber)就已建議公共計劃採取隨機定序法。因此對於邁爾斯來說,賽雷拉的成功是他的光榮,也讓他獲得平反。
根據他自己的解釋,他在創建美國基因組研究所時,銀行里只有2000美元存款。但他很快就扭轉財運。1993年初,急於趕上基因組熱潮的英國製藥公司史克必成(Smithkline Beecham)支付給溫特1.25億美元,取得對他那張愈寫愈長的新基因名單的獨家商業使用權。一年後,《紐約時報》揭露,溫特在人類基因組科學公司擁有10%的股份,價值1340萬美元。他不愁沒錢花了,重金砸下400萬美元買了一條82英尺長的賽艇,還在大三角帆上印上他20英尺的巨幅畫像。
幸運的是,維康信託基金會的摩根(Michael Morgan)適時提供了一劑強心針。在溫特公布消息后短短數天內,摩根宣布維康將把提供給桑格中心的資金增倍,使總金額達到3.5億美元左右。雖然這次宣布的時機看起來好像是在直接響應溫特的挑戰,事實上增加經費一事已醞釀了一段時間。不久,美國國會也提高了對公共人類基因組計劃的補助。競賽就此展開。其實,從一開始就註定至少會有兩個優勝者。https://read•99csw.com惟有兩組人類基因組序列存在,科學才會受益,因為有兩組結果,才能互相比對檢視(在超過30億鹼基對的情況下,勢必會有一兩個錯誤)。另一個贏家無疑是應用生物系統公司:他們能賣出更多PRISM定序儀了,畢竟公共人類基因組計劃中大多數的實驗室現在都必須購買它們,才趕得上溫特的進度。
由於先前已經建立起基因地標,因此儘管基因組序列相當龐大,比起邁爾斯在隨機定序法的無地標世界的遭遇,公共計劃的組合工作似乎沒有那麼嚇人。(在最後的分析中,賽雷拉使用了公共計劃供人自由取用的基因圖譜信息。)事實上,公共計劃正是以為可以依賴這些地標,才低估了運算上的困難,所以當賽雷拉增加計算機能力時,公共計劃的注意力仍然集中在定序工作上。一直到相對後期的時候,公共計劃的領導人才發現,儘管有圖譜,他們仍然得解決如何去組合這個大問題,就像到聖誕夜還在努力組合新腳踏車的父親一樣。完成(以及組合好)基因組「草圖」的日期已經定在6月底,但一直到5月初,公共計劃仍找不到組合所有序列的方法。最後,前來解危的救星居然是加州大學聖克魯斯分校的一位研究生。
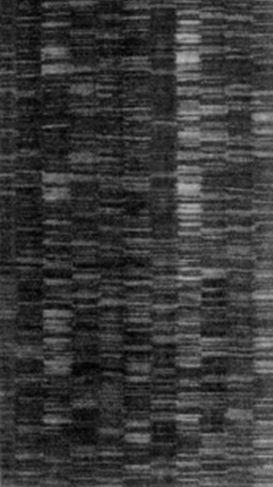
字裡行間:自動化定序機輸出的序列。每個顏色都代表四種鹼基中的一種。

肯特用100台計算機為公共計劃組合出基因組草圖
柯林斯在弗吉尼亞州謝南多厄河谷(Shenandoah Valley)一個95英畝大、沒有自來水的農場長大。起初他在家裡自學,由分別是戲劇教授和劇作家的雙親教導,他7歲時就已寫出《綠野仙蹤》(The Wizard of Oz)的舞台劇本並自任導演。但是科學的魔力把柯林斯拖離戲劇生涯;在耶魯完成物理化學博士學位后,他進入醫學院,從此開始醫學遺傳學領域的研究生涯。柯林斯屬於科學界的罕見品種:他是一位對宗教非常虔誠的科學家。他曾回憶說,在大學時,「我是非常惹人厭的無神論者。」但這一切在醫學院時改變,那時「我看到人們在病情嚴重時為生存而戰,有許多人戰敗。我看到有些人依賴信仰,也看到信仰帶給他們的力量。」柯林斯不僅為人類基因組計劃帶來卓越的科學見解,同時也注入他的前任所缺乏的一個精神層面。到了90年代中期,人類基因組圖譜的初稿已經完成,而定序技術也快速發展后,該直搗核心去研究A,T,C和G了——定序時機終於來臨。我們仍遵循早先由國家科學院委員會制定的方針,先從一連串的模型生物做起:先是細菌,然後是比較複雜(亦即基因組比較複雜)的生物。低等的線蟲是第一個非細菌的大挑戰,英國桑格中心的薩爾斯頓(John Sulston)和美國華盛頓大學的瓦特斯頓(Bob Waterston)聯手研究線蟲,成果斐然,為國際合作立下良好楷模。線蟲的序列在1998年12月發表,一共有9700萬個鹼基對。線蟲頂多隻有書頁上的逗號那麼大,細胞數目是固定的959個,卻擁有大約2萬個基因。
基因組(genome)是存在於每個細胞核里的遺傳指令。(事實上,每個細胞包含兩個基因組,分別來自父方和母方:我們從父母繼承到兩個染色體複本,這讓我們每個基因都有兩份,因此有兩個基因組。)基因組的大小視物種而不同。從人類單一細胞內DNA數量的測定值來看,我們可以估計人類基因組(單一細胞核內所含的一半DNA)大約包含31億個鹼基對,也就是3100000000個A,T,G或C。
在迎接賽雷拉的挑戰上,最重要的人物莫過於蘭德(Eric Lander)。因為設想出幾近完全自動化的定序過程、由機器人取代技術人員的人就是他,而擁有衝勁、能使這個設想成真的人也是他。從他的履歷就可看出,他的確是很有衝勁的人。他出身紐約市布魯克林區,在曼哈頓的司徒佛遜高中(Stuyvesant High)時是數學神童,曾贏得西屋科學獎第一名;他是普林斯頓那一屆的畢業生代表(1978),後來以羅德獎學金(Rhodes fellowship)在牛津拿到博士學位。他在1987年拿到的麥克阿瑟「天才」獎似乎已顯多餘。他母親說她完全不知道兒子何以這麼傑出:「我很想說這是我的功勞,其實不是……我只能說這是運氣。」
在此同時,美國能源部也以強調這個計劃將是一項科技偉業而爭取到1200萬美元的經費。我們必須記得:在那個年代,製造技術是日本居於領導地位;底特律遭逢被日本汽車業趕過的危機,許多人擔心美國在高科技領域的優勢將會是下一個倒下的骨牌。據說當時三大日本集團(松井、富士和精工)已經聯合起來,準備生產一天能替100萬個鹼基對定序的機器。最後證明這隻是誤傳,但這類疑慮的確讓美國基因組計劃獲得動力,如同當年要趕在蘇聯之前把美國人送上月球的情形。
這類投機性的基因專利對醫學的研發造成嚴重影響,長期而言,也會導致醫療選擇變得更少和更差。事實上,這些投機者等於取得了對潛在藥物目標亦即尚未問世的藥物或療法所針對的蛋白質的專利。對大多數的大製藥廠來說,生技公司在對基因功能僅有微薄或根本沒有生物信息的情況下,針對藥物目標所提出的基因專利,已經成為毒藥。這些基因的壟斷者要求龐大的權利金,造成財務失衡,對藥物的發展不利;其實在研發合格藥物的過程中,克隆藥物目標頂多佔1%的工作而已。此外,如果一家公司製造出針對特定目標的藥物,同時又擁有與該目標相關的基因專利,那麼這家公司沒有理由要立即針對這個目標發展更好的藥物。原因就在於如果你擁有專利,而別家公司就算可以合法進行研發,也會因成本高得嚇人而不願參与競爭,那麼你又何必投資于研發?
聚合酶連鎖反應是極為簡單的過程。第一步是以化學方法合成兩個引子(primer),所謂「引子」是短鏈的單股DNA,長度通常在20個鹼基對左右。這兩個引子和目標DNA片段的兩端具有互補的序列,它們就像是把我們想要的基因用括弧括出來。我們首先從組織樣本中萃取出作為模板的DNA,然後加入引子。這個模板實際包含整個基因組,而我們的目標是大量擴增想要的目標區。在加熱到攝氏95度時,DNA的雙股會分開。這讓每個引子得以和20個鹼基對的模板片段產生互補結合,在兩條單股的模板DNA的一端,便會形成具有20個鹼基對的雙股DNA「小島」。DNA聚合酶(這種酶能把新的鹼基對合併至單股DNA上的互補位置,藉此複製出DNA)只有在DNA已經是雙股的位點上才會開始作用。因此,DNA聚合酶會從引子和模板片段互補結合后所形成的雙股小島啟動,由每個引子開始製造與模板DNA互補的股,從而複製出目標片段。等這個過程結束時,目標DNA的總數會增加一倍。接著我們可以重複加熱步驟,整個過程再來一遍:由兩個引子標示出的DNA片段的複本再度倍增。這個過程每循環一次,目標片段的數目就會倍增。經過25次循環后,亦即在不到兩小時內,目標DNA的數量便擴增225倍(約3400萬倍)。事實上,最初由模板DNA,引子,DNA聚合酶和自由的A,T,G,C所構成的混合溶液,最後會變成目標DNA片段的濃縮溶液。
1998年1月,製造自動化定序儀的應用生物系統公司總裁杭卡皮勒邀請溫特去參觀他的最新機型PRISM3700。雖然溫特對這台機器大為讚賞,但他對接下來的事毫無心理準備。杭卡皮勒建議溫特成立一家新公司來進行人類基因組定序,由應用生物系統的母公司Perkin Elmer提供資金。溫特毫不猶疑地捨棄了美國基因組研究所,反正他跟人類基因組科學公司的黑索廷關係也早已惡化。他立刻成立了新公司,也就是後來的賽雷拉基因公司,它的座右銘是:「速度最重要,發現不能等。」他們計劃以全基因組隨機定序法定序整個人類基因組,並且釆用三百台杭卡皮勒的機器加上許多計算機,其計算能力僅次於美國國防部。這個計劃將費時兩年,耗資在2億美元到5億美元之間。
最重要的是,人類基因組包含我們之所以為人的關鍵。人類和黑猩惺的受精卵在剛形成時,至少在表面看來是無法分辨的,但一個包含的是人類基因組,另一個是黑猩猩基因組。從這個受精卵開始,一個相當簡單的細胞會變成極度複雜的成體,例如人就是由一百兆個細胞所構成的,這整個過程就是由DNA一手操控。但是只有黑猩猩基因組能製造出黑猩猩,也只有人類基因組能製造出人類。人類基因組包含大量的組合指令,控制每一個人的發育成長。人類的本性就是寫在這本指令書里。
在接下來的幾年間,私人與公共計劃領導人之間尖酸的言論交鋒,成為報紙科學版中固定出現的題材。這些一來一往的言辭,終於連柯林頓總統也看不下去,他對科學顧問說:「把這件事搞定……讓這些傢伙合作。」儘管如此,定序工作仍繼續進行,而溫特也證明全基因組隨機定序法可用於相當龐大的基因組,通過和公共計劃中負責研究果蠅的機構合作,他在2000年初宣布完成九*九*藏*書果蠅基因組的草圖。然而,果蠅基因組僅含有極少的重複性垃圾DNA,因此賽雷拉基因公司成功組合了它,並不能保證全基因組隨機定序法也適用於人類基因組。
自動化定序最初是胡德在加州理工學院的實驗室發展出來的。胡德以前是高中橄欖球校隊的四分衛,曾率領隊友連續幾年獲得蒙大拿州冠軍;他把從中學到的團隊精神用於學術工作上。他的實驗室兼容並蓄,有化學家、生物學家和工程師,這個團隊果然成為技術創新的領導者。
在早期,聚合酶連鎖反應的主要問題在於DNA聚合酶在攝氏95度時會被摧毀。因此實驗人員在這25次循環中,每次都必須重新加入這種酶。聚合酶的價格昂貴,因此儘管它很有潛力,但是如果消耗量太大的話,顯然就不是符合經濟效益的實用工具。幸好大自然提供了解決之道。大腸桿菌是這種酶的初始來源,而最適合大腸桿菌的溫度是攝氏37度,然而,有許多生物是生存在比這個溫度還高許多的環境中的;這些生物的蛋白質(包括DNA聚合酶這類酶)在經過無數世代的自然選擇后,已經可以適應高溫。現在一般是用從黃石公園熱泉里的水生嗜熱菌(thermus aquaticus)分離出的Taq DNA聚合酶來引發連鎖反應。
溫特到布雷納的實驗室參觀時,對於他們的cDNA策略大感驚異,簡直等不及要趕回他在華府市郊國家衛生研究院的實驗室,用這種技術製造出一個新基因寶庫。即使只定序出每個基因的一小部分,溫特就可以判定它是否是科學上的新發現。在1991年6月,國家衛生研究院的官員敦促他為337種新基因申請專利,儘管他對其中許多基因的功能一無所知。一年後,在更廣泛地運用這個技術后,溫特又向專利局申請了2421個序列的專利。我認為,不知道這些序列的作用,卻盲目申請它們的專利,是令人無法容忍的。既然莫名其「妙」,這麼做到底在保護什麼?這隻不過是先發制人,壟斷其他人日後作出真正重大發現所可能帶來的商機。我向國家衛生研究院高層人士力陳其非,但徒勞無功。他們仍堅持為這種做法解釋開脫(後來這政策也逆轉了),而這也意味著我在政府官僚體系裡的職業生涯即將結束。當國家衛生研究院的院長希利(Bernadine Healy)迫使我在1992年辭職時,我心中可以說五味雜陳。在華盛頓這個壓力鍋熬了四年,已經夠了。但對我來說真正重要的是,在我離開時,人類基因組計劃已經步上正軌。
在人類基因組計劃的第一階段,隨著DNA定序策略不斷改進,建立圖譜的腳步也加快了。近期目標是找出整個基因組的粗略輪廓,讓我們得以決定序列中每個區段的位置。基因組必須劃分為易於處理的一個個區塊,我們要建立的,正是這些區塊的圖譜。起初我們用人造酵母菌染色體(yeast artificial chromosome, YAC)來達成目標,這是奧森發明的方法:把大塊的人類DNA片段植入酵母菌細胞內,在植入后,這些YAC會跟正常的酵母菌染色體一起複制。但是在將一百萬鹼基對的人類DNA片段植入單一的YAC時,發現出了問題:這些片段會更換位置。既然建立圖譜就是要找出染色體上的正常基因順序,序列更換可以說是最糟糕的情況。這時紐約州布法羅(Baffalo)的德·榮(Pieter de Jong)發展出來的人造細菌染色體(bacterial artificial chromosome, BAC)成了救星。BAC比較小,只有10萬到20萬個鹼基對長度,換位的情況也少得多。
結果人類基因組計劃並未促成大量分析DNA的新方法問世,相反地,最後是通過改良舊方法和自動化,DNA的分析量才得以逐步增加,先是數百到數千,然後增加到數百萬鹼基對序列。然而,有一項革命性的技術對這個計劃特別重要,亦即可以大量製造特定DNA片段的技術(若要定序一段特定的DNA,就需要大量該段DNA)。在80年代中期以前,放大一個特殊的DNA區域必須使用柯恩-波耶分子克隆法:先取出想要的DNA片段,將它插入質體,再把改造后的質體插入細菌細胞。然後這個細胞會開始複製,每次都複製出先前插入的DNA片段。等細菌生長到足夠的數目時,再從整個細菌群落所有的DNA中取出你要的DNA片段。雖然自從波耶和柯恩最初的實驗后,這個程序已經精進不少,但仍相當繁瑣又耗時間。因此,聚合酶連鎖反應(PCR)的發展成功就成了一大躍進:它可以達到相同的目標,但是只需幾個小時,就可以選擇性地擴增你想要的DNA,而且不需要處理麻煩的細菌。
這個消息傳開時,剛好是後來所謂的「公共」人類基因組計劃(有別於民間的「私人」計劃)領導人即將在冷泉港實驗室會面的前夕。含蓄地說,大家對這消息都不太能接受。我們這個全球性的計劃已經花掉大約19億美元的公共資金。如同《紐約時報》的說法,現在我們除了老鼠基因組的序列以外,可能拿不出別的成績,而溫特則可以輕鬆地搶走這場競賽的聖杯:人類基因組。最令人不悅的是溫特對後來被稱為「百慕大原則」(Bermuda Principles)的做法嗤之以鼻。1996年,人類基因組計劃在百慕大開會(溫特也參加了),決議只要一獲得序列數據,就立即公布。我們一致同意基因組序列應該是公共財產。現在成為叛徒的溫特卻有不同的想法:他宣稱會延後三個月才公布新的序列數據,以便把專利權賣給有興趣購買優先獲知權的製藥公司和其他任何人士。
1988年5月,溫嘉丹要求我主持國衛院的基因組計劃。在我表明不願為此放棄冷泉港實驗室的主任職位后,他設法替我安排以兼職方式來做國衛院的工作。我無法再拒絕。18個月後,人類基因組計劃成為一股無法阻擋的力量,而國務院的基因組辦公室也升級為人類基因組研究國家中心(National Center for Human Genome Research),我被任命為首屆主任。
溫特從小在加州長大,最初寧可去衝浪,也不想繼續求學。但是在越戰時擔任醫護兵的一年間受到一些心理創傷后,似乎讓他立定志向。回美國后,他在短時間內從加州大學聖地亞哥分校拿到生理學和藥理學的學士與博士學位。他之所以會從學術界轉往商業界發展,從他個人的財務看來也相當合理:

DNA定序進入量產:麻省理工學院的懷特海德研究所
1995年,人類基因組科學公司對稱為CCR5的基因申請專利。他們的初期序列分析顯示,這個基因為免疫系統中一種細胞表面的蛋白質編碼,因此值得「擁有」,因為這類蛋白質有可能成為免疫系統藥物起作用的目標。黑索廷的公司為類似的基因提出140項專利申請,CCR5是其中之一。1996年,研究人員發現了CCR5在HIV病毒入侵免疫T細胞的途徑中所扮演的角色。他們也發現CCR5的突變是使人對艾滋病產生抵抗力的原因:當時已經觀察到,有些男同性戀重複接觸HIV,卻一直沒有染病,最後發現這些人都擁有突變的CCR5基因。因此,無論是當時或現在,CCR5都註定要在我們對抗HIV的努力上扮演重要的角色。找出CCR5在艾滋病傳染中扮演的重要角色,需要辛苦的研究和紮實的科學工作,但在這兩方面都毫無貢獻的人類基因組科學公司卻有機會坐收龐大的利益,只因它最早宣稱擁有那個基因;而且CCR5專利將迫使每次應用這個知識的人都得繳一筆費用,這等於對每一分錢都很重要的醫學研究工作征重稅。但黑索廷的反應一點也不慚愧:「如果在專利獲得核准后,有人將這個基因用於藥物開發……並且是基於商業用途,他們就是侵害了專利權。」他還相當憤慨:「我們不但有權要求損害賠償,而且是兩三倍的賠償。」

基因組計劃朝商業發展:1995年5月美國《商業周刊》以黑索廷(左)及溫特為封面人物,稱他們為「基因之王」。
2000年6月26日終於來臨。柯林頓在白宮,布萊爾在唐寧街10號首相官邸同時宣布,人類基因組計劃完成第一份草圖。這場競賽以平手收場,雙方共享榮耀。至少在這天早上,對陣雙方都把敵對情緒拋在腦後。柯林頓宣稱:「今日,我們學習上帝創造生命的語言。在獲得這個深奧的新知識后,人類即將獲得全新、龐大的治療疾病的力量。」偉大的時刻搭配偉大的言辭。在面對這個被媒體喻為和阿波羅號首度登陸月球一樣偉大的成就時,很難不感到光榮,即便這次成功的「官方」日期定得有點武斷。其實這時定序工作根本還沒完成,而且一直要到6個多月以後,基因組的正式科學報告才會問世。有人便嘲諷說,這個宣布時機不是根據人類基因組計劃的時程,而是根據柯林頓和布萊爾的行程制訂的。
我們的報告在1988年2月出爐。基因組的草圖是在2001年發表。在我撰寫本書的期間,全球各地的定序實驗室不斷交出更多成果,到了2003年,也就是發現雙螺旋體50周年,我們這個委員會的報告出爐15年時,我們已看到定序工作全部完成。