04 扮演上帝:訂製DNA分子
下一個挑戰是從截然不同的生物體上取出DNA(例如人類DNA),然後製造混合質體。早期有個實驗成功地把非洲爪蟾(African clawed toad)的基因植入大腸桿菌的質體,再把這個質體植入細菌內。每次細菌群落的細胞分裂時,都會複製那段插入的爪蟾DNA。以容易令人混淆的分子生物學詞彙來說,我們「克隆」(clone)了爪蟾的DNA。後來證明哺乳動物的DNA也可以克隆。回想起來,其實這不足為奇。無論來源為何,DNA片段畢竟仍是DNA,化學性質仍然相同。大家很快就發現,柯恩和波耶複製質體DNA片段的做法,顯然適用於取自任何生物的DNA。
舉例來說,假設現在有一個模板鏈,它的序列是GGCCTAGTA。在實驗中,這一鏈有許多複本。現在我們用DNA聚合酶來複制這一鏈,並且事先準備好包含正常的A,T,G,C和一些雙脫氧A (ddA)的混合物。這時聚合酶會開始按順序複製,先從一個C開始(與待複製鏈的第一個G對應),接著依序加入C,G和G。但是等聚合酶遇到第一個T時,有兩種可能:它可以把正常A加到愈來愈長的鏈上,也可以加入雙脫氧A。如果它加入的是雙脫氧A,這一鏈的生長到此為止,這條鏈會比較短,而且末端是一個雙脫氧A: CCGGddA。然而,如果它剛好接上的是正常A,則它會繼續加入鹼基,例如T,C等等,一直要到聚合酶又遇到T時,才有機會再製造一個雙脫氧「終點」。這條鏈會比先前那條長一點,它的序列是CCGGATCddA。每次聚合酶遇到T時(亦即要將A加入這條鏈時);都會有類似的情形;如果它隨機選到的是正常的A,這條鏈會繼續加長,如果它選上的是ddA,則這條鏈的生K到此為止。
既然如此,插入序列的存在理由是什麼?它們的存在顯然會使細胞過程變得極度複雜,因為必須先把它們刪掉才能形成信使RNA。這個編輯過程很棘手,特別是從信使RNA中切除一段插入序列時,例如在切除凝血第八因子的信使RNA時發生錯誤,就有可能會造成移碼突變,進而使形成的蛋白質毫無用處。有個理論認為插入序列只是退化的結果,也就是地球上早期生物在進化后所遺留下來的殘餘物。但是對於為何會有插入基因,以及它們對偉大的生命密碼有何用途,至今仍是經常爭論的議題。
定序確認為20世紀70年代最了不起的發現之一。我們已經知道基因是由A,T,G和C構成的線狀鏈,而且這些鹼基是根據遺傳密碼每次三個三個地轉譯的,進而創造出由氨基酸構成的長鏈,亦即蛋白質。但是羅伯茲(Richard Roberts)和夏普(Phil Sharp)等人的傑出研究都顯示,其實在許多生物體中,基因是以一段段的方式存在的,重要的編碼DNA之間穿插著許多不相干的DNA片斷。惟有在轉錄信使RNA之後,「編輯」過程才會把不相干的部分切除掉。這就像本書中突然跑出一段顯然隨機插入的無關段落,例如棒球或羅馬帝國史。吉爾伯特將這些橫插一腳的序列稱為「插入序列」(intron),而真正負責蛋白質編碼的序列(亦即基因具有實際功能的部分)則稱為「表現序列」(exon)。後來發現,插入序列主要是複雜的生物體的特色,像細菌就沒有插入序列。有些基因的插入序列特別多,例如在人體內,凝血第八因子的基因(血友病患者的這種基因可能發生了突變)有25段插入序列。凝血第八因子是很大的蛋白質,大約有2000個氨基酸那麼長,但是為它編碼的表現序列僅占基因總長的4%而已,其餘96%都是插入序列。
但是為什麼細菌不會切斷自己DNA的GAATTC序列?這正是埃布爾的第二大發現。在製造以特定序列為目標的限制酶時,細菌也會製造第二種酶,它能以化學方式——在鹼基中加入甲基團CH3——來修飾本身DNA上任何位置的相同序列。因此當限制酶EcoRl大肆破壞病毒DNA的GAATTC序列時,在細菌DNA中經過修飾的GAATTC序列就不會被認出來。

序列大師吉爾伯特(左)和桑格
基因尋寶遊戲席捲整個分子生物學界。1981年,冷泉港實驗室開了一門進階夏季課程,教導基因克隆技術。其後三年中,此課程的實驗室手冊《分子克隆》(Molecular Cloning)銷售了8萬本。DNA革命的第一階段(1953—1972),也就是早期發現雙螺旋和遺傳密碼所引起的興奮,最終使得大約3000名科學家投入這個領域。第二階段從重組DNA和DNA定序技術開始,但在10年多一點的時間內,這個領域的人數就暴增了100倍。
儘管辯論激烈,想藉由訂定國家法律來規範重組DNA實驗的企圖,幸好一直沒有成功。馬薩諸塞州參議員肯尼迪(Ted Kennedy)很早就加入這場論戰,在愛希勒瑪會議結束后僅一個月時,就在參議院舉辦了一場聽證會。1976年他寫信給福特總統,建議聯邦政府管制產業與學術界進行DNA研究。1977年3月,我到加州州議會的聽證會上作證。布朗(Jerry Brown)州長也在場,我趁機建議他:除非斯坦福大學的科學家罹患不明疾病,否則不應考慮這方面的立法行動。如果那些實際處理重組DNA的人都很健康,立法者就不該把焦點放在這裏,而應該去關注那些會對民眾健康造成更明顯威脅的事情,例如騎自行車等等,這樣才能提供給民眾更好的服務。
新DNA股的混合物,每股的長度不一,末端都是加有標記的雙脫氧鹼基。在凝膠中被電場分離的DNA產物,從膠體底端往上讀就是新DNA股的序列。
重組DNA革命的下一個大進展,來自細菌的抗藥性研究。在20世紀60年代科學家已經發現,許多細菌不是按照標準方式(通過細菌基因組的突變)對某一種抗生素產生抗藥性,而是經由引入外來的DNA片段來產生抗藥性,這種DNA片段稱為質體(plasmid)。質體是獨立於細菌染色體以外的小段環狀DNA,在細胞分裂期間,跟細菌基因組的其他成分一起複制和傳遞。在特定情況下,質體也可以在細菌之間互相傳遞,讓接收者能快速獲得「出生」時所沒接收到的完整遺傳信息。這些信息通常包含能帶來抵禦抗生素能力的基因。抗生素所造成的自然選擇有利於那些具有抵抗因子(質體)的細菌細胞。
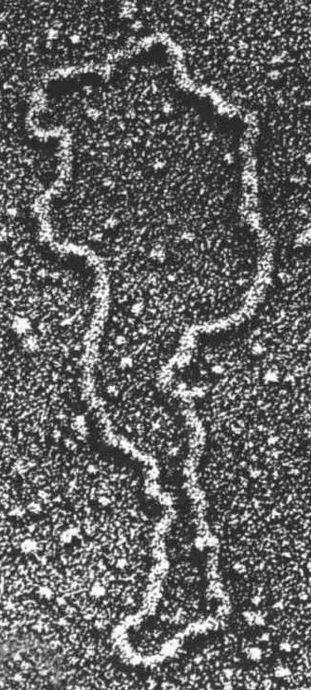
電子顯微鏡下的質體
桑格不像是你心目中的諾貝爾獎雙料得主。他出生於貴格派基督教家庭,在第二次世界大戰期間,他是社會主義者,曾經拒服兵役。更罕見的是,他從不宣揚自己的成就,寧可把自己獲read•99csw.com得諾貝爾獎的證據藏起來:「得到一個不錯的金牌,就放在銀行保險箱里;得到一張證書,就放在閣樓里。」他甚至曾拒絕接受爵士爵位:「爵位會讓你與眾不同,對吧?但我並不想與眾不同。」退休后,桑格以照顧劍橋市郊自宅的花園為樂,偶爾也會到「桑格中心」走走,但總是保持低調。桑格中心成立於1993年,位於劍橋附近,是專門從事基因組定序的機構。
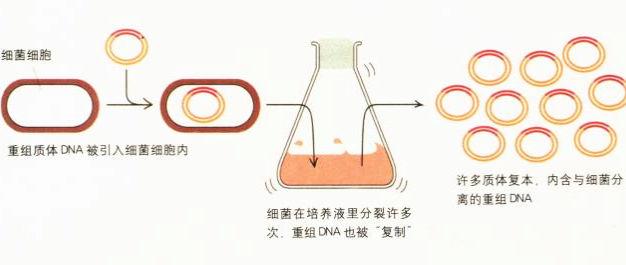
重組DNA:克隆一個基因
然而,即使這些譏諷的言詞,也無法阻止那些態度堅決的人反擊他們眼中如同普羅米修斯般傲慢的科學家。馬薩諸塞州坎布里奇市市長維路奇(Alfred Vellucci)就是發起這類反對「聖戰」的人之一。維路奇靠捍衛小市民的形象而贏得政治聲名,但這次卻是以城裡頂尖的教育機構,亦即麻省理工學院和哈佛為代價。重組DNA風暴提供了他最佳的政治作秀機會。那時一篇報道生動地描繪了當時的情況:
科恩伯格利用DNA聚合酶來複制病毒DNA,並且藉由加入連接酶,使DNA的兩個衣端相連,讓整個分子形成一個連續環,如同原本的病毒。這個「人工」病毒DNA的行為就跟自然的病毒DNA一模一樣。這種病毒通常在大腸桿菌里繁植,而科恩伯格在試管里製造出的DNA分子也一樣。他只用兩個酶、一些基本的化學成分和用來製造複本的病毒DNA,就創造出具有生物作用的分子。媒體報道說,他在試管中創造出生命,約翰遜總統還因而將這個突破稱為「驚人的成就」。
在此同時,斯坦福大學醫學院的博格(Paul Berg)對這件事的前景大感振奮,反倒不在意SV40的威脅,他預料在未來可以利用這種病毒,把DNA片段(外來基因)引入哺乳動物的細胞。這種病毒可以成為哺乳動物體內的分子運輸系統,一如柯恩用質體在細菌體內所做的。但柯恩主要是把細菌當作複印機,用以放大DNA的某個特定片段;但在博格的眼中,SV40是把矯正基因引入遺傳疾病患者體內的方法。博格超越了他的時代,他想要做的正是今日所謂的基因治療:把新的遺傳物質引入病患體內,彌補先天遺傳得到的基因缺陷。
除了性染色體X與Y以外,人類染色體都是根據大小來編號。1號染色體最大,21號和22號染色體最小。在每個細胞的總DNA量中,有8%位於1號染色體內,大約有2.5億對鹼基。21號和22號染色體則分別有4000萬和4500萬對鹼基。即使是最小的DNA分子,例如微小病毒的DNA分子,至少也含數千對鹼基。
1961年,科學家從用於調配小兒麻痹疫苗的恆河猴腎臟中,分離出一種稱為SV40的猿猴病毒(SV為simian virus的首字母)。這種病毒自然存在於猿猴體內,雖然一般認為它對這些猴子沒有影響,但實驗很快證明,它可能導致嚙齒動物罹患癌症,在特定的實驗條件下,甚至可能在人類細胞中引起癌症。由於小兒麻痹疫苗接種計劃自1955年實施以來,已經讓數百萬名美國兒童感染這種病毒,因此這項發現著實令人心驚。小兒麻痹防治計劃是否無意間造成一整個世代的人罹患癌症?幸好,答案似乎是否定的:SV40並未造成任何癌症的流行,而且它對人類似乎就跟對猿猴一樣無害。然而,儘管SV40已成為分子生物實驗室的常客,但許多人對它是否安全仍存有疑慮。我對這件事特別關心,因為那時我已是冷泉港實驗室的主任,在我們的實驗室里,有愈來愈多年輕科學家正在研究SV40,想找出癌症的遺傳基礎。
博格在1959年到斯坦福大學擔任初級教授,這是名望比他高的科恩伯格從聖路易市的華盛頓大學被延攬到斯坦福時就與學校說好的條件之一。其實博格和科恩伯格的淵源甚早,他們都出生於紐約的布魯克林區,也都參加過由伍爾夫(Sophie Wolfe)老師指導的高中科學社團。博格曾經回憶說:「她讓科學變得有趣,也讓我們分享想法。」其實這說法太過含蓄,伍爾夫在埃布爾拉罕林肯高中帶領的社團出了三位諾貝爾獎得主,分別是科恩伯格(1959)、博格(1980)和結晶學家卡利(Jerome Karle,1985)。他們全都曾公開推崇她對自己的影響。
斯坦福大學的柯恩(Stanley Cohen)是研究質體的先驅。他在高中生物老師的鼓勵下,朝醫學領域發展。他剛從醫學院畢業時,原本打算當內科醫生,後來因為不想被征去當軍醫,就接受了國家衛生研究院的研究職位。他很快就發現自己喜歡研究勝於行醫。1971年,他有了重大突破,設計出一種能誘導大腸桿菌細胞自細胞外引入質體的方法。事實上柯恩等於讓大腸桿菌「變形」,如同40年前格里菲斯通過攝入(uptake) DNA,把不會致命的肺炎菌株變成會致命的菌株。不過,柯恩的研究是把含有抗藥性基因的質體,注入先前對抗生素沒有抵抗力的菌株內。這個菌株所產生的後代就會對抗生素具有抗藥性,並且在每次細胞分裂期間,都將質體DNA原封不動地傳給下一代。

DNA大辯論:1975年愛希勒瑪會議期間,(左起)辛格(Maxine Singer)、津德(Norton Zinder)、布雷納和博格設法解決重組DNA所引起的問題。辛格和津德也都是美國生化和遺傳學界的翹楚。
分子生物學革命的第二階段於是展開。在第一階段,我們的目的在於描述DNA在細胞內的運作;現在,有了重組DNA之後,我們等於擁有了干預和操控DNA的工具。我們可以看見「扮演上帝」的機會正快速地發展,前景可觀。這種得以鑽研生命奧秘的龐大潛力,以及在對抗癌症等疾病上獲得實質進展的機會,令人相當興奮。但是柯恩和波耶在大幅拓展了我們的科學視野之際,是否也開啟了潘多拉的寶盒?分子克隆是否潛藏著未知的危險?我們能否繼續興高采烈地把人類的DNA片段植入大腸桿菌?大腸桿菌在人類腸道的微生物叢林中是佔優勢的物種,萬一這些被改變的生命形態潛入人體的話,怎麼辦?簡單地說,在一些人擔憂地吶喊「這就像在製造細菌版的科學怪物」時,我們能否心安理得地充耳不聞?
等20世紀70年代結束時,柯恩和波耶最早的實驗所引發的問題,漸漸不再是問題。雖然我們被迫繞了遠路,但至少這證明了分子生物學家願意承擔社會責任。
我灰心地離開會場,自覺與大多數同事格格不入。柯恩和波耶也很沮喪,他們跟我一樣認為,身為科學家應具有良好判斷力,許多同事卻自動繳械,只為了被媒體視為「好人」,而非潛在的「科學怪人」(Dr. Frankenstein)。read•99csw•com事實上,絕大多數的人都沒有處理過致病生物,並不了解這些限制對我們研究這類生物的人所造成的影響。許多武斷的決定讓我感到很惱怒。例如,冷血脊推動物的DNA可以研究,但哺乳動物的DNA卻是大多數科學家的禁區;顯然研究蟾蜍的DNA是安全的,但研究老鼠的DNA則否。我認為這種愚昧的想法簡直不可思議,便「以毒攻毒」地指出:難道大家不知道蟾蜍會讓人長疣嗎?但我這種戲謔的反對徒勞無功。

超級安全的P4實驗室,專供針對致命病毒!例如伊波拉病毒)或發展生物武器等進行生化研究之用。在20世紀70年代晚期,要用遺傳工程方法來研究人類DNA的科學家也必須使用P4級實驗室。
這種感覺就像被選入西班牙政府召集的特別委員會,評估哥倫布和他的水手將承受的風險。這個委員會要制定出一套方針,看萬一發現地球是平的的時候該怎麼做,以及水手可以朝地球邊緣安全地前進多遠等等。
1980年,桑格、吉爾伯特和博格共同榮獲諾貝爾化學獎,博格是因為改進了重組DNA技術,貢獻卓著而受到嘉獎。(柯恩和波耶竟然都沒有得獲此殊榮,令人感到意外。)這是桑格第二次獲得諾貝爾獎。他在1958年因為發明蛋白質定序法(亦即定出其氨基酸的序列),並將它運用於人類胰島素而第一次榮獲桂冠。但是桑格的蛋白質定序法和他為DNA定序所發明的方法,毫無關聯;無論是從技術或構想的角度來看,這兩者之間都沒有因果關係。他在發明這兩種方法時,都是從頭開始,他或許稱得上是分子生物學早期歷史上首屈一指的技術天才。
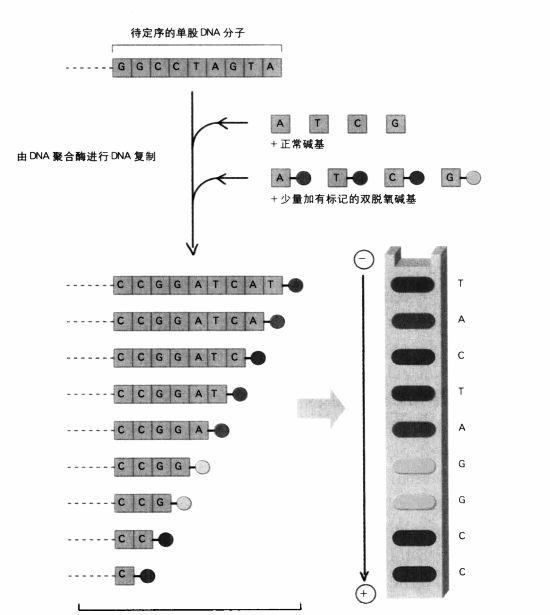
桑格的DNA定序法
DNA分子非常長,任何一條染色體內都只有一個連續的DNA雙螺旋分子。一些評論家很愛把雙螺旋跟紐約市電話簿的數據數目或多瑙河的長度相比,好讓人了解這些分子有多龐大。但這幫不上我的忙,因為我對紐約市有多少電話號碼毫無概念,而提到多瑙河只會讓我想起斯特勞斯的圓舞曲,不會想到任何線性長度。
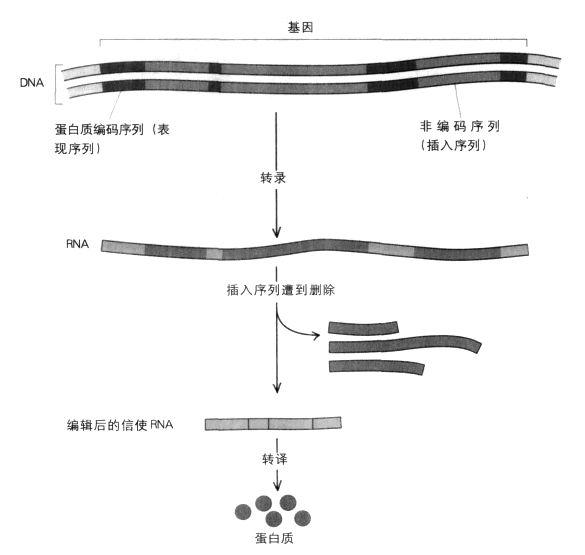
插入序列和表現序列:在製造蛋白質前,信使RNA中不負責編碼的插入序列會被刪除。

遺傳工程先驅波耶(左)與柯恩

SV40轎車:博格和他以病毒命名的本田(Honda)車
在布雷納的推動下,這個折中的提案終於通過。當然,兩種最極端意見的支持者都有許多不滿,但這場會議最終仍達成了一致的建議,允許科學家繼續研究已經喪失功能、不會致病的細菌,並強制要求在進行涉及哺乳動物DNA的研究時,必須使用昂貴的防範設備。這些建議後來發展成一整套方針,並在一年後由美國國家衛生研究院公布。
人數增加也創造出一個全新的產業:生物技術(biotechnology)。1975年後,關切DNA的人不再僅限於想了解生命分子基礎的生物學家。分子不再是身穿白色實驗袍的科學家擅長的學術領域,它已經進入一個截然不同的世界,而這個世界里的人大半穿著時髦西裝,打著真絲領帶。克里克把他在劍橋的家取名為「黃金雙螺旋」(Golden Helix),如今這個名字也有了全新的意義。
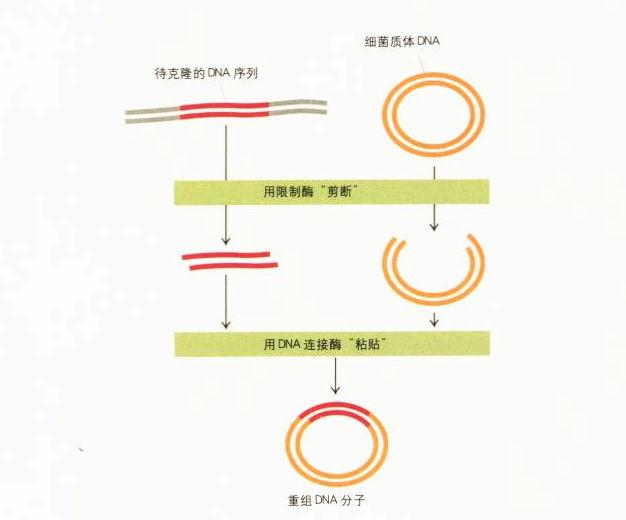
重組DNA分子
正當柯恩和波耶,以及此時也投入這領域的其他人,正努力解開剪貼DNA分子的細節時,博格已規劃了一個相當大胆的實驗:他想看看植入外來DNA片段的SV40,是否能將那段外來基因輸送至動物細胞內。為了方便起見,他從現成可用的細菌病毒(即噬菌體),取得要植入SV40的外來DNA,再來檢視包含SV40DNA和噬菌體DNA的合成分子是否能成功地入侵動物細胞。如果這個分子跟博格希望的一樣,真能入侵動物細胞,就代表他有機會利用這個系統,把有用的基因植入人類細胞。
我鄭重要求貴院調查這些發現。我也希望貴院能調查這些「怪異生物」(如果真的存在的話)是否跟在新英格蘭區所做的重組DNA實驗有關。
1975年2月,在加州海邊小鎮帕西菲克格羅夫市(Pacific Grove)的愛希勒瑪(Asilomar)會議中心舉辦了一場會議,一共有140位來自全球各地的科學家出席。羅傑斯把這場會議叫做「潘多拉寶盒大會」(Pandora's Box Congress)。它的目的是要一勞永逸地決定,重組DNA可能帶來的危害是否真的比好處多。我們是否要將暫緩改為永遠不得進行?是要不顧一切潛在的危險,奮勇前進,還是要等發展出明確的保護措施后再說?身為大會籌備委員會的主席,博格也是這場會議的名譽主持人,必須設法在會議結束前制定出一致的聲明,但這幾乎是不可能的任務。
這讓我們獲得什麼結果?在這個實驗結束時,我們可獲得仵多自模板DNA複製而來、長度不一的鏈;它們的共同點呢?末端都是ddA。
在波耶和柯恩成功地完成重組DNA實驗的消息曝光后,各界對生物危害(biohazard)的疑慮便接踵而至。1973年夏天,在新罕布希爾州舉行的有關核酸的科學會議上,大多數人投票贊成請美國國家科學院(National Academy of Sciences, NAS)立即調查這項新科技的危險性。一年後,由國家科學院成立並由博格擔任主席的委員會,在寫給《科學》(Sciences)雜誌的信上公布調查結論。我本人和其他許多科學家,包括在相關研究上最為積極的柯恩和波耶在內都簽署了這封信。在這封「暫停信」(Moratorium Letter)上,我們呼籲「世界各地的科學家」自動自發地暫緩所有關於重組的研究,「直到這類重組DNA分子的潛在危險經過更妥善的評估,或直到有足夠的方法能防止它們擴散為九*九*藏*書止」。這項聲明的重點在於承認「我們的關切是基於對潛在可能的判斷,而不是基於已經證實的風險,因為在目前,與這類DNA分子的危險性有關的實驗數據極少」。
首先,他們用限制酶把這兩種質體分別切斷,接著把它們混合置入同一個試管並加入連接酶,讓被切斷的末端相連。就這個混合物的一些分子而言,連接酶只是使被切斷的質體恢複原狀,亦即它們只是把相同質體的兩端連接起來。但有時連接酶會連接不同質體的DNA片段,從而產生想要的混合體。在完成前述步驟后,下一步是用柯恩的質體輸入(plasmid-importing)技巧,把所有的質體移植到細菌里,再把培養出來的菌群放到塗了四環素和卡那黴素的培養皿上。恢複原狀的質體仍只會讓細菌對其中一種抗生素產生抗藥性,因此這些細菌在有兩種抗生素的環境里無法存活。惟有具有重組質體的細菌才能生存:因為這種質體是由兩種DNA重組而成,一種DNA編碼可以抵抗四環素,另一種可以抵抗卡那黴素。
在英國劍橋作研究的布雷納提供了一份相關數據,這類數據當時極為少見。他收集了一種大腸桿菌的菌落,對於分子克隆研究來說,這種稱為K-12的大腸桿菌是最佳的實驗品。有些罕見的大腸桿菌菌種偶爾會引起食物中毒,但是絕大多數大腸桿菌菌種是無害的,布雷納假設K-12也不例外。他關心的不是自己的健康,而是K-12的「健康」:K-12在實驗室外是否能生存?他把這種病菌加入牛奶里(因為直接喝不太好喝),一口氣把這可怕的飲料喝光。然後他監測自己的排泄物,看是否有任何K-12細胞在他的腸道內繁殖。結果他沒找到任何K-12細胞,顯然K-12儘管可以在培養皿里繁殖,但在「自然」世界卻無法生存。然而還是有人對這個推論表示質疑:即使K-12本身無法生存,這並不能證明它們不能和其他能在人類腸道內生存的菌種交換質體(或其他的遺傳信息)。因此,經過「改造」的基因仍有可能進入腸道細菌的族群中。布雷納主張我們應該培養絕對無法在實驗室外生存的K-12菌種。我們可以通過基因改造,確保這個菌種只有在提供特殊養分時,才能生長。當然,我們可以列出一些永遠無法從自然界獲得的養分,而且這些養分惟有在實驗室里才有可能全部同時存在。因此,被改造過的K-12將會是「安全的」細菌,只能在我們控制的研究環境中生存,但真實世界註定要死亡。
科恩伯格是首位在試管里「創造生命」的人。如前所述,他在20世紀50年代發現DNA聚合酶,這種酶通過從兩股業已分開的親代股形成互補股的方式來複制DNA。後來他專心研究某種病毒DNA,最終得以用這種酶複製出病毒DNA全部的5300對鹼基。但這個產物不是「活的」;雖然它的DNA序列跟親代一樣,卻不具生物活性。這當中還缺乏某種神秘物質。直到1967年,美國國家衛生研究院的蓋烈特(Martin Gellert)和斯坦福大學的萊曼(Bob Lehman)才同時找到它:一種被命名為連接酶(ligase)的酶,它能把DNA分子的兩個末端「黏」起來。
其實愛希勒瑪會議達成的一致決議,只不過是使重要研究延後了5年,許多年輕科學家的事業也因此中斷了5年,令人沮喪。
我最害怕的是,社會大眾對分子生物學熾烈的偏執恐懼,會導致嚴苛的法律。以繁雜難懂的法律文字來規範可做和不可做的實驗,只會對科學造成傷害。實驗計劃必須呈交給政治導向的審查小組,無可救藥的官僚制度,會像老祖母衣櫥里的蛀蟲一樣難以擺脫。同時,我們在盡最大努力評估研究工作真正的風險時,卻因完全缺乏數據而難以定論,在邏輯上也很難證明絕無風險。雖然重組DNA技術從沒造成過任何災難,媒體卻老愛想像「最壞的情況」。在談到1977年華盛頓的一場會議時,生化學家赫佩爾(Leon Heppel)巧妙地總結了科學家在這場爭論中感受到的荒謬:
吉爾伯特在華盛頓特區念高中最後一年時,經常逃課到國會圖書館去閱讀物理學方面的書。後來他像所有科學神童一樣,積極追尋他們心目中的「聖杯」(Holy Grail),以奪得西屋科學獎(Westinghouse Talent Search)為目標,並在1949年順利贏得這個獎。(後來在1980年,他接到了斯德哥爾摩瑞典學院的電話;統計數據顯示,贏得西屋獎是未來贏得諾貝爾獎的最佳指標之一。)吉爾伯特在大學和研究所都專攻物理學,我在1956年抵達哈佛,一年後,他獲得物理系的教職。然而當我引起他對RNA實驗研究的興趣后,他立即放棄物理學,轉到我的領域。吉爾伯特思路縝密,不屈不撓,從此他一直是分子生物學的前鋒。然而,就這兩種定序法而言,桑格的方法比較經得起時間的考驗。吉爾伯特用來切斷DNA的化學物質中,有一些具有毒性,很難處理,一不小心便會危害到研究人員本身的DNA。另一方面,桑格的方法是使用在細胞里自然複製DNA的酶,亦即DNA聚合酶。他的技巧在於從已經稍微改變的鹼基對中製造複本。桑格不僅使用DNA(脫氧核糖核酸)中形成的正常「脫氧鹼基」(deoxy base) A,T,G,C,還加入了一些「雙脫氧鹼基」(dideoxy base)。雙脫氧鹼基有一個獨特的性質:DNA聚合酶會自然而然地將它們結合至成長中的DNA鏈(亦即組成的複本是與稱做「模板鏈」[template strand]的那條單股DNA互補的鏈),然後它就再也不能把任何鹼基加入這條鏈。換句話說,這個複製鏈只能加長至雙脫氧鹼基為止。
現在假設其他三種鹼基也經過相同的程序,以T為例,我們使用A,T,G,C和ddT的混合物,結果形成的分子不是CCGGAddT,就是CCGGATCAddT。
然而,在20世紀70年代的後期,分子生物學並未因為政治因素而完全停頓。這幾年中仍有一些重要進展,而且它們大多仍是以具爭議的波耶-柯恩分子克隆技術為基礎。最重要的突破是發明了讀取DNA序列的方法。定序需要大量我們感興趣的特定DNA片段,但是在克隆技術發展成功之前,科學家一直無法做到定序,只有一些小病毒DNA例外。如前所見,本質上,克隆即是將想要的DNA片段插入質體,再把質體插入細菌。在分裂和生長后,這些細菌會製造出大量DNA片段的複本,這時從細菌里取出DNA片段,就可進行定序。
一身暗紅色的雙針織夾克和黑長褲,幾乎掩不住啤酒肚的黃條紋藍襯衫,再加上歪斜的牙齒和塞得鼓鼓的口袋,維路奇代表了一般美國人對科學家、科技官僚和自以為聰明的哈佛書獃子所感受到的無奈。他們認為這些人自以為可以操縱世界,結果卻留下一堆爛攤子。而要面對這些爛攤子的人是誰?不是那些書獃子。最後得自力救濟,清理這堆爛攤子的人總是維路奇和一般的勞動大眾。
無論是按照美國國家衛生研究院或其他國家管制單位的規定,愈來愈多的實驗都顯示,重組DNA程序不會製造出科學怪物(維路奇先生,對不起,可沒有什麼「怪異的橘眼生物」)。到了1978年,我寫道:「相較於幾乎其他所有以D開頭的東西,DNA真的非常安全。與其用戈德堡式的圖畫大肆渲染實驗室里製造的DNA會導致人類的絕種,倒不如去擔心匕首、炸藥、狗、狄氏殺蟲劑或酒醉駕駛等的影響。」
九_九_藏_書雖然波耶和柯恩當時都在舊金山灣區工作,但在夏威夷那場會議前,兩人一直沒碰過面。在那個限制酶鮮為人知的年代,波耶卻已是這個領域的專家,他和同事剛找出EcoRl酶切割地點的序列。波耶和柯恩很快就發現,結合他們倆的專長之後,可以將分子生物學帶往嶄新的境界,也就是剪貼和複製的世界。有天晚上,他們在威基基(Waikiki)附近一家小吃店開始夢想重組DNA技術的誕生,還把構想寫在餐巾紙上。他們充滿遠見的未來大計後來被喻為「從腌牛肉邁向克隆」。
1972年11月,剪下、貼上和複製這三個要素終於在夏威夷一場討論質體的會議上會合。當時剛在加州大學洛杉磯分校獲得永久教職的年輕教授波耶(Herb Boyer)出席了那場會議,質體先驅柯恩自然也在場。波耶跟柯恩一樣來自美國東岸,他在賓州西部念高中時擔任過美式足球校隊的前鋒,他很幸運,因為球隊教練正好是他的科學老師。
那時候,有兩種定序技術同時問世,發明人分別是馬薩諸塞州坎布里奇(舊譯也作「劍橋」)市哈佛大學的吉爾伯特(Wally Gilbert)和英國劍橋的桑格(Fred Sanger)。吉爾伯特從大腸桿菌的β-半乳糖苷酶基因調控系統中分離出抑制子蛋白質后,就對定序DNA產生興趣。如前所見,他已經證明抑制子會跟基因附近的DNA結合,防止它轉至RNA鏈上。現在他想知道那個DNA區塊的序列。後來他偶然間遇到蘇聯傑出的化學家米爾扎別科夫(Andrei Mirzabekov),米氏建議他使用效力強大的不同化學物之組合,從特定鹼基的位置切斷DNA鏈。
1971年夏天,在冷泉港實驗室,博格的一位研究生就這項實驗計劃提出報告。列席的一位科學家聽完后憂心不已,立即致電博格。他問博格說,萬一事情剛好朝相反方向發展怎麼辦?換句話說,萬一SV40病毒不但沒有接納這個病毒DNA並把它插入動物細胞,反而被噬菌體DNA操控,造成SV40DNA被|插入大腸桿菌等細菌細胞的話,怎麼辦?這並非不切實際的假設。畢竟,把自己的DNA插入細菌細胞,正是許多噬菌體的「天賦使命」。由於大腸桿菌無所不在,與人類的關係親近,又是人類腸道中的主要成員,博格原本立意良善的實驗,有可能製造出危險的,攜帶可能致癌的SV40猿猴病毒的大腸桿菌菌落。雖然博格並不憂心,但仍接受了這位科學家的看法,他把這個實驗延後,等到對SV40的致癌潛力有進一步的了解后再說。
這一年不久,美國國家衛生研究院重組DNA諮詢委員會(RAC)在華府提出少了許多限制的指導方針,大多數的重組研究都獲得允許,可以進行,包括腫瘤病毒DNA的研究。1979年,健康、教育及福利部部長卡里法諾(Joseph Califano)同意這些修正,至此,無意義地暫緩哺乳動物癌症研究所造成的停滯時期終於結束。
然而,在聯合署名后,我立即沮喪起來,後悔在這封「暫停信」上簽名。分子克隆顯然具有可以為這個世界帶來許多益處的潛力,如今,在歷經辛苦的研究,而且生物學的大革命就在眼前之際,我們卻一致決定退卻。這情況令人手足無措。羅傑斯(Michael Rogers)在1975年為《滾石》雜誌(Rolling Stone)所寫的專題報道中指出:「分子生物學家在做這類實驗時面臨的危機,最終可能跟核物理學家在發明原子彈前幾年的情況相同。」我們究竟是謹慎,還是怯懦?當時我無法確定,似是心裏已經隱隱覺得,答案可能是後者。
那場會議有媒體在場,一頭霧水地聽著科學家交換最新的術語。律師也在場,提醒我們別忘了這當中有一些法律問題需要解決。例如,假設我的一位技術人員得了癌症,我身為重組研究實驗室的主任,是否要負法律責任?科學家由於天性和訓練使然,不願意在缺乏相關知識的情況下隨便預測。大家本就懷疑這場會議根本不可能達成一致的決定。或許博格也同樣感到懷疑。無論如何,他選擇讓與會者自由發言,而不是以主席身份強勢領導。結果這場會議變成一場自由討論,不時有人漫無邊際地講些不相干的事,冗長地說明自己的實驗室所進行的重要研究。從怯懦的「繼續禁止」到狂熱的「禁止什麼,科學要繼續發展才行」,各種意見雜陳,而我當然是支持後者。當時我認為,只因為未知和尚未量化的危險就延後研究,是更不負責任的做法。世上有許多人因癌症或纖維囊泡症(cystic fibrosis)病入膏肓,這或許是他們惟一的希望,我們有什麼權利拒絕他們?
在今天由赫斯特集團發行的《波士頓先驅美國人》(Boston Herald American)上,有兩則報道令我相當憂心。在馬薩諸塞州多佛市,有人看到一隻「怪異的橘眼生物」;在新罕布希爾州的豪利斯市(Hollis),有位男士和他的兩個兒子遇到一隻「九尺高的多毛生物」。
即使在破解遺傳密碼后,要發展出能執行這些程序的基本工具,似乎仍遙不可及。然而,20世紀60年代晚期和70年代初期的一些發現,卻在1973年巧妙地整合,形成所謂的「重組DNA」(recombinant DNA)技術,亦即編輯DNA的能力。這不只是一般實驗技術的精進而已,科學家似乎在朝夕間具備了調整DNA分子的能力,能夠創造出自然界前所未見的分子。我們可以藉由操控支撐所有生命的分子,來「扮演上帝」。許多人覺得這種想法令人不安。恐懼科技的美國著名作家裡夫金(Jeremy Rifkin)就擔憂地認為,每一個新遺傳技術都像是一個「科學怪物」,不過他所謂重組DNA「重要性可與火的發現相比美」的說法,倒是相當貼切。
到了20世紀70年代初期,製造「重組DNA」的所有成分都已齊備。首先,我們利用限制酶切斷DNA,分離出想要的基因序列;然後利用連接酶把這個序列「貼到」質體內(這時質體就像一張磁碟,內含我們想要的序列);最後只要把這張「質體磁碟」插入細菌細胞,就可以複製我們所要的DNA片段。細菌細胞分裂時會像複製本身的遺傳物質一樣,也複製含有我們所要的DNA片段的質體。因此,只要把一個質體植入單一細菌細胞內,細菌在繁殖時就可製造出大量我們所選擇的DNA序列。只要讓這個細胞不斷繁殖,最終就可形成由數十億個細菌構成的龐大菌落,創造出數十億個我們想要的DNA複本。這個菌落成了我們的DNA工廠。
數月後,波耶在舊金山的實驗室開始跟往南40英里、柯恩位於帕洛阿爾托(Palo Alto)的實驗室合作。波耶負責的自然是限制酶研究,而柯恩則負read.99csw.com責質體程序。幸好當時柯恩的實驗室有一位技術員安妮·張(Annie Chang)就住在舊金山,所以能往返兩地,運送珍貴的實驗物品。他們的第一個實驗是以製造混合體為目標,也就是把兩種能讓宿主對特定抗生素產生抗藥性的質體,混合成所謂的「重組體」。其中一個質體上的基因(即DNA片段)可以抵抗四環素(tetracycline),另一個質體上的基因可以抵抗卡那黴素(kanamycin)。(最初的結果如同預期,攜有第一種質體的細菌被卡那黴素殺死,而攜有第二種質體的細菌則被四環素殺死。)這個實驗的目標,是要創造出能使宿主對兩種抗生素都產生抗藥性的「超級質體」(super-plasmid)。
在經過四種不同的合成方式后,亦即分別加入ddA,ddT,ddG和ddC后,我們獲得四組DNA鏈,這些鏈的末端分別是ddA,ddT等。現在只要我們能根據這些迷你鏈個別不同的長度,把它們加以分類,就可以推估出DNA鏈的序列。但這些迷你鏈的長度只是稍有差異而已,要怎麼做呢?首先,我們把所有的DNA片段放在裝滿特殊膠體的板子上,再把這個板子放到電場里。在電場的拉力下,DNA分子被迫在凝膠中移動,特定長度的鏈的移動速度跟體積呈對應關係:短鏈的移動速度比長鏈快。在特定的時間範圍內,最小的迷你鏈(比如88頁的示圖中用的是簡單的ddC)會移動得最遠,稍長的CCddG移動的距離短一點,更長的CCddG移動的距離又會短一點。現在,桑格的策略應該已經很清楚:在一定時間后,我們就可以讀取這些迷你鏈在凝膠中的相對位置,從而推論出這個DNA片段的序列:先是C,然後再一個C,接著是G等等。
波耶跟柯恩一樣,也是學過雙蠓旋的新一代科學家。他對研究DNA充滿熱情,甚至把自己養的一對暹羅貓命名為沃森和克里克。他在大學畢業後會進入細菌遺傳學的研究領域,沒人感到驚訝,他的教練更覺得這是理所當然的事。
漫畫家筆下的重組DNA實驗室,畫中借用了亞當夏娃受蛇誘惑偷吃禁果的聖經故事,禁果上寫著「EcoRl」(限制酶)。
這些方針讓許多參加愛希勒瑪會議的人以為,從此可以暢通無阻地進行以克隆「安全細菌」為主的研究。但凡是在這種想法下進行研究的人,很快就發覺困難重重。根據大眾媒體所散播的邏輯,如果連科學家都認為有值得擔心之處,一般社會大眾自然更應該感到憂懼。當時美國正值「反文化」(counterculture)的年代,儘管這股反傳統的浪潮已開始式微,但畢竟尚未完全消失。越戰和尼克鬆的政治生涯才剛結束,多疑的社會大眾根本無力了解科學家本身也才剛開始研究的複雜事物,他們只是一股腦兒採信所謂領導階層在醞釀邪惡陰謀的理論。至於我們科學家則相當驚訝地發現自己被歸類為統治階層,儘管我們從沒想過自己屬於這個階層。波耶是名副其實的嬉皮科學家,但是就連他也在舊金山灣區地下報紙《柏克萊毒舌報》(Berkeley Barb)的萬聖節特刊中,發現自己名列灣區「十大妖怪」之一,以前只有貪污的政客和跟工會作對的資本家才會上榜。

馬薩諸塞州坎布里奇市的聽證會,最後造成全市禁止進行重組DNA研究。中部左側為哈佛大學的普塔什尼,下邊左側為在第二章中曾提到的梅索森。右下角為維路奇市長。—位聽眾高舉「建立智慧,而非圍堵」的標語牌。
DNA分子太過龐大,是早期分子生物學上的一大難題。為了掌握特定的基因(即特定的一段DNA),我們必須設法從朝兩端不規則延伸的極長DNA分子中,把這段DNA分離出來。不僅如此,我們還得設法把它「放大」,才能取得足夠研究使用的樣本。這也就是說,我們需要一個分子編輯系統:要有一把分子剪刀,能將DNA剪成容易處理的片段;再來要有一罐分子膠水,以便操縱這些片段;最後還需要一個分子複印機,以便將剪下和分離的片段放大。這相當於今日的文書處理器功能:剪下、貼上和複製(cut、paste、copy)。
在20世紀60年代,瑞士生化學家埃布爾(Wemer Arber)對發展重組DNA技術的貢獻,則比較出人意表。埃布爾的興趣不在於研究像生命的分子基礎這類大問題,而在於病毒自然史上的一個疑點。他研究一些病毒DNA在侵入細菌宿主細胞后被分解的過程。有些宿主細胞會把特定的病毒DNA視為外來物質,選擇性地攻擊它們,但不是所有的宿主細胞都如此(否則病毒將無法繁殖)。這過程是如何發生的?原因何在?無論是在細菌、病毒、植物或動物身上,自然界所有的DNA都是相同的基本分子。細菌在攻擊病毒的DNA時,為什麼不會攻擊自己的DNA?埃布爾找到的第一個答案是一群能降解DNA的酶,稱為「限制酶」(restriction enzyme)。由於限制酶會切斷外來的DNA,因此只要細菌細胞內有它們的存在,就可以限制病毒的生長。這種切斷DNA的作用是針對特殊序列所產生的反應:特定的限制酶只有在認出某個特別序列時,才會切斷DNA。例如首批被發現的限制酶之一EcoRl,就會辨識和切斷鹼基序列GAATTC。
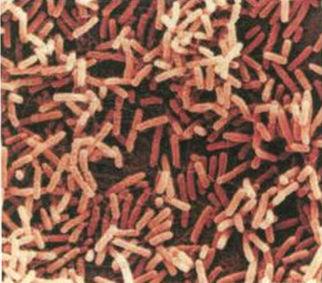
腸道微生物大腸桿菌:如果你願意去檢視的話,在每一克的人類糞便中,可以找到大約1000萬個大腸桿菌。
一旦我們發現真核生物(eukaryote,指細胞內有專供儲存遺傳物質的細胞核的生物)基因的普遍性質后,立刻掀起了一股科學淘金熱。一批批擁有尖端技術裝備的科學家競相成為分離(克隆)出重要基因和找出其特色的第一人。最早期的寶藏之一就是造成哺乳動物罹患癌症的突變基因。只要完成數種經過徹底研究的腫瘤病毒(例如SV40)的DNA定序,就可以明確指出致癌基因。這些基因能把正常細胞變成具有癌症特質的細胞,例如生長失控和有細胞分裂傾向,最後造成腫瘤。沒多久,分子生物學家就開始分離出人類癌細胞的基因,最後證實人類的癌症起因於DNA的變化,而不是像先前所想的,只是單純、意外、無關基因的不正常增生而已。我們發現了會加速或促成癌生長的基因,也發現了會減緩或阻止癌生長的基因。細胞似乎就像一輛汽車,需要兼具油門和剎車才能正常運作。
情況為什麼會演變得如此激烈?哈佛的科學家曾建議在校內興建防護設施,在嚴格遵守國家衛生研究院的新規定下,進行重組DNA研究。維路奇逮到機會,再加上哈佛和麻省理工的左翼組織基於本身反DNA的主張而支持他,他設法在坎布里奇市通過一項長達數月的禁令,禁止進行所有的重組DNA研究。結果在短時間內造成當地人才明顯流失,哈佛和麻省理工許多生物學家紛紛投奔到政治敵意沒那麼濃的地方,維路奇卻獲得替社會大眾監督科學發展的大名聲。1977年,他寫信給國家科學院: