11 狩獵基因:人類疾病的遺傳學
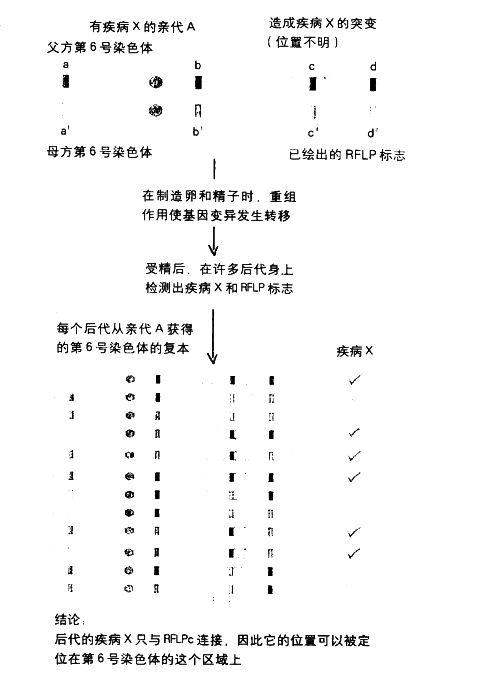
繪製一種疾病基因的圖譜:為了方便起見,這裏只用兩代和一些個體來作說明。如果這個分析的統計數據要夠精確,則需要大量相關個體的資訊。
波茲坦等人的目標是尋找每條染色體上的RFLP標誌,而且要找到足夠的數量,才能確保基因組的每一點至少都在一個RFLP附近。但他們很快就發現最初估計的數目150個,必須往上修正。但是學術界的實驗室,例如懷特的實驗室,並未因此受挫,仍然著手分離RFLP,而商業生物技術界也很快加入了行動。
纖維囊泡症患者肺部會堆積濃稠的黏液,造成呼吸困難。肺氣管壁細胞無法清除黏液,結果細菌在黏液中繁殖,造成肺部感染。在抗生素問世以前,這種疾病的患者只有10年壽命,但如今他們的存活率已改善很多。纖維囊泡症也是最常見的遺傳疾病之一,在北歐血統的人當中,發生率約為1/2500。纖維囊泡症具有隱性遺傳特性:一個人要遺傳到兩份突變基因才會發病。但是由於北歐裔中擁有一份突變基因(這些人本身有一份正常基因,所以不會發病)的比例多達1/25,所以兩個各有一份突變基因的人結合,並把突變基因遺傳給子女的幾率相當高。因此,在研發這種疾病的診斷檢測法成為實際可行的目標后,這立即成為醫學界的優先工作。
下一步甚至更加困難。知道紐約位於華府和波士頓之間,總比只知道它位於美國某處來得好。但是當你必須從華府徒步走到波士頓,一碼碼地尋找寫著「歡迎來到紐約!」的標示牌時,光是知道這個線索恐怕也沒多大用處。從連結分析的標準來看,100萬個鹼基對或許已經很接近,但是從基因克隆專家的標準來看,這可是迢迢長路,因為他們在分析DNA區段時,一次只做—個鹼基對。為了找出最接近纖維囊泡症基因的兩個RFLP之間的區段,徐立之和當時在密歇根大學的柯林斯合作(多年後,柯林斯繼我之後成為人類基因組計劃的領導人)。
但是親切只能緩和亨廷頓氏症對這麼多人的殘害,南西遠征之旅的最終目的在於找到造成這種疾病的基因。但是她要怎麼利用在馬拉開波湖建立的系譜來找出這個禍首?這當中的關鍵在於人類遺傳學的進展。
人類對遺傳學的探索有漫長的歷史,從我們早期的祖先對特徵的世代傳遞產生好奇心開始,一直至今。然而,在這歷程中,科學基礎其實都很薄弱。達文波特想藉由尋找他所謂「低能」的遺傳基礎,來支持他的優生計劃,這種意圖幾乎不能算是科學。若要衡量這個領域的發展有多慢,從以下事實即可見一斑:長久以來定義人類這個物種的一項基本遺傳參數,根本是錯誤的;一直到1956年,也就是發現雙螺旋三年後,人類染色體的數目才正確地定為46個,而不是自1935年以來眾所公認的48個。但是自從RFLP連結研究開始后,在20年間,我們以驚人的速度獲得大量知識,原本貧瘠的領域開始蓬勃發展。在完成人類基因組的定序工作后,我們可能很快會找到所有重大遺傳疾病的基因。接下來的問題在於:我們要怎麼運用它們?
但是命運會獎賞勇者。古塞拉回到實驗室后,對更多的RFLP標誌進行了測試,結果他震驚地發現,標號G8的第12個RFLP標誌,似乎跟愛德華州那個家族的亨廷頓氏症有連結關係的跡象。因此他急切地等待馬拉開波湖的樣本,一收到它們就開始針對G8進行測試。當時的興奮感幾乎抵擋不住:G8的確與這種疾病連結。到了1983年的夏天,古塞拉終於突破萬難,才試過12個RFLP就找到了跟亨廷頓氏症的連結。但這真的不是普通的運氣而已:這是第一次在沒有性別連結的協助,在對這種疾病的生化基礎也沒有任何了解的情況下,在染色體上找到了一種人類疾病的基因位置。這突然打開了一個嶄新的科學遠景,看來我們終於可以精密地分析自古以來折磨人類的所有遺傳缺陷了。RFLP證明它們的確是有效的工具,而且在人類基因組中可處理的部分追蹤到亨廷頓氏症后,應用強大的基因克隆技術來分離出這個基因,真的只是時間遲早的問題了。
至於古塞拉,他並沒有等待馬拉開波湖的樣本。我記得他是在1982年10月冷泉港的一場會議上,提出了他最早期的數據。他從愛德華州一個飽受亨廷頓氏症折磨的小家族取得樣本,在12個RFLP中,他只挑了5個來做測試,一一檢視它們是否跟這個疾病有關,結果一個都沒有。我有種大海撈針的感覺,他就像只撈出一些海水一樣。惟有仔細分析所有的海水,也就是整個龐大的基因組,或是有非常好的運氣,才有可能找到古塞拉想找的目標。因此當他最後在下結論說,「現在要找到亨廷頓氏症的基因只是遲早的問題而已」時,我不由地在心裏響應,「是啊,只不過得『非常遲』而已。」
合研公司保持沉默時,威廉森和懷特離有相同發現的日子也不遠了。他們各自寫了研究報告,交給《科學》的英國對手《自然》雜誌,並且都提到這些關鍵的RFLP位於第7號染色體上。徐立之非常憤怒:在合作夥伴的欺瞞下,他即將失去宣稱首位發現這個連結的權利(在科學界,亞軍是沒有任何獎賞的)。但是多尼斯—凱勒說服了《自然》也接受多倫多-合研研究小組宣布這個位置的論文。因此,最後在11月28出刊的《自然》雜誌上,一共出現了三篇論文,編者還寫了篇文章,解釋三者的由來。
若要找到亨廷頓氏基因,南西和其他對遺傳疾病感興趣的人知道,他們必須像半世紀以前摩根和他的學生對果蠅所做的一樣,只不過把研究對象換成人。如同先前(在第一章中)所見,摩根讓擁有不同性狀組合(例如白眼[相對於紅眼]和卷翅[相對於直翅])的親代交配,比較這些遺傳標誌同時發生在混種子代的比率,然後利用這些數據,決定控制這些性狀的基因在染色體上彼此相隔距離的遠近。但是人類遺傳學的進展之所以落後果蠅遺傳學,主要有兩大原因。第一,基於道德和實際理由,不可能對人類進行當時盛行的遺傳分析實驗:你不能叫兩個你感興趣的人類交配,然後在兩星期後分析他們的後代。第二,就算人類可以任意交配,他們也仍然缺乏遺傳標誌。摩根能追蹤因為個別基因發生特定的突變而在果蠅外觀上造成的簡單又明顯的差異。但是在人類身上,這麼容易遺傳又能輕易分析的性狀並不多;就連眼睛顏色也是由數個基因,而非單一基因所操控。此外,我們可以用X光照射果蠅或使用其他會造成突變的製劑來增加遺傳變異的程度;但是,也幸好是,我們沒有可用於人類的這類方法。一直要到重組DNA時代來臨后,這兩大難題才得以解決。
結論:後代的疾病X只與RFLPc連接,因此它的位置可以被定位在第6號染色體的這個區域上,但是如同前述,在1980年那篇有關RFLP的重要論文發表后,有些人看到的是另一條路(南西就是其中之一)。在建立完整圖譜的工作加足馬力后,麻省理工的豪斯曼(David Housman)也卯起勁來進行波茲坦認為現階段不可能做到的任務:找出亨廷頓氏症基因的位置。他把這件很難辦到的事,交給了剛在他實驗室完成博士論文研究的古塞拉(Jim Gusella)。現在建立圖譜的工作將進攻另一個陣線。
多倫多的研究小組採集了血液樣本並萃取出DNA,但需要許多經費才能完成研究。就在這時,他們和序析公司(Sequana)接觸上,該公司的成立宗旨正是要找出疾病基因。序析公司贊助了這項研究,而這也立即引來這家公司剝削島民的指控,島民們對於自己在序析公司的商業策略中扮演的角色或許並沒有充分的了解。自稱為「促進農村發展國際基金會」的加拿大積極分子宣稱,序析公司的行為「是一種生物剽竊(biopiracy)……違反DNA樣本採集對象的基本人權」。序析公司宣稱已經發現兩個造成容易罹患哮喘體質的基因,但是在申請歐洲專利前一直拒絕公布它們,這種做法自然引起更多「生物剽竊」的指控。這些基因位於第11號染色體上,後續對高異質性的大陸人口的研究證實,第11號染色體的確與哮喘有關。因此,看來造成特里斯坦—達庫尼亞島上哮喘發病率高的遺傳因子,不是只跟南大西洋海島的孤立居民有關而已。數年後,史蒂芬森(Kari Stefansson)及其公司解碼遺傳(deCODE Genetics)也陷入類似指控的大風暴中,相較之下,序析公司歷經的「生物剽竊」風暴可說是小巫見大巫。有鑑於要為每一種疾病都找一個類似特里斯坦-達庫尼亞島的小群人口來研究,是既冗長又沒有效率的做法,史蒂芬森推論他需要的是一個人口大得多的孤立島嶼,這樣可以一次在島上居民中尋找數個疾病的基因。史蒂芬森剛好就是在這樣的島嶼上出生的。
然而,對合研公司1987年公布的圖譜最嚴重的批評,在於它的標誌分佈得很不均勻。在第7號染色體(與合研的目標之一纖維囊泡症有關)上有63個標誌,但第14號染色體上只有6個。在標誌少的染色體上,這些標誌之間的距離要比整個基因組上的平均值大得多。懷特對合研公司的做法感到特別不悅。他找到的標誌超過470個,但是他向來在一條染色體上已找出足夠密度的RFLP時才公布數據。他評論說,「我們的數據比他們多出許多,但我們永遠不可能像他們那樣公布成果,因為我們認為仍有重要的缺口必須填補。」他拒絕接受合研公司那套冠冕堂皇的說法。不過,無論那些說法是否冠冕堂皇,合研公司的圖譜證明了製作整個基因組的圖譜是可行的,而且本身也是很重要的進展。
在這時候就喝醉好像還嫌太早,更不用說還是一位穿著打扮完美無九-九-藏-書瑕的中年婦女,但是當她搖搖晃晃地過街時,看起來的確像是醉了,就連在附近法院執勤的警察也責罵她公開出醜。事實上,莉歐娜·魏克斯勒(Leonore Wexler)並沒喝醉酒,她只是開始走向一個可怕的命運,一個在她眼前奪走了好幾位親人的命運,也是一個她原本希望能夠倖免的命運。
史蒂芬森是哈佛大學的神經學家,對多發性硬化症和阿爾茨海默氏症(Alzheimer disease,即老年痴呆症)這類複合基因病很感興趣。在認定自己的同胞最適合做遺傳研究的對象后,他擬訂了一個計劃,連結譜系和醫療記錄,建立用於搜尋基因的資料庫。儘管這個計劃的目的很有價值,但當地的隱私權法規卻使這個計劃窒礙難行,直到冰島國會於1998年通過保健資料庫法為止。這項立法授權「建立與管理無個人辨識數據的中央健康資料庫,以增加知識,促進健康與保健服務」。
徐立之在多倫多的研究小組不是惟一致力於尋找纖維囊泡症基因的單位,倫敦的威廉森先前研究過DMD基因,現在也加入到尋找纖維囊泡症基因的行列,猶他州的懷特也在能拿到摩門教會所收集的大規模的家譜資料后,開始搜尋這種基因。摩門教的「祖先檔案」記錄,是為了讓教友能夠替生前不是教徒或在教會於1830年成立前就已過世的祖先祈福,好讓家族永遠團聚在神的國度中。宗教和遺傳學的需求很少這麼契合過。
狩獵亨廷頓氏症基因的科學家決定改弦易轍,放棄矛盾的連結分析,把焦點放在亨廷頓氏症患者之間最相似的區段。這個方法終於將搜尋範圍縮小至只剩50萬鹼基對,而這個研究領域也進入了基因克隆技術的時代。他們獲得的第一批成果令人失望:在這個區段的右半邊找到了三個基因,但是在亨廷頓氏症患者體內,這三個基因並沒有任何異狀。他們不屈不撓地又研究了這個區段的左半邊,結果發現一個基因,並替它取了一個單調的名字IT15。在經過十年的努力,失敗了許多次之後,命運之神終於再度對他們微笑。這個基因包含的一小段序列CAG,會像用於DNA指紋技術的STR般一再重複。最後他們發現,正常人的CAG重複數少於35個;CAG重複數超過40個的人,成年後會罹患亨廷頓氏症;在CAG重複數超過60個的罕見情況下,這人會在20歲之前就罹患嚴重的亨廷頓氏症。CAG是谷酰氨酸的基因密碼,所以CAG每重複一次就會讓這個蛋白質多增加一個谷酰氨酸。就亨廷頓氏症患者而言,由亨廷頓氏症基因編碼的蛋白質含有額外的谷酰氨酸,這個差異可能對腦細胞里的蛋白質的行為造成影響,其原因可能在於它會使分子在腦細胞內聚合成黏性腫塊,在不明機制下造成細胞死亡。
首先,研究人員必須先分析患病男童的X染色體,找出在這個家族中連結至DMD基因的RFLP。接著,從含有胎兒細胞的胎盤或羊水樣本取得胎兒的DNA。如果這個胎兒的RFLP跟患病男童的RFLP相符,我們可以相當肯定這個未出生的胎兒未來也會患病。為什麼只是「相當肯定」呢?本書的第一章曾提及,當卵細胞產生時,成對的染色體會發生重組,交換DNA:兩條第1號染色體會互相交換,兩條第2號染色體會互相交換,兩條X染色體也會,諸如此類。如果這個交換剛好發生在X染色體上RFLP標誌與DMD基因之間的區域,則連結正常基因的RFLP有可能會變成連結至突變的基因(DMD基因)。根據經驗,對於最先連結至DMD的RFLP,這種情況的發生率大約是5%,所以根據RFLP所作的診斷只有95%左右的準確度。這5%的不準確度是重組作用所造成的不可避免的結果。因此,雖然這種診斷已經代表極大的進展,但是若要達到100%的準確度,仍然必須找到這個基因本身,而不能只靠跟它連結的標誌。
其中一個原因在於合研公司毫不客氣地採用大學實驗室的數據,卻不公布自己得到的數據,這種做法令學術界感到氣憤。(在這方面,合研首開同時使用產學兩界研究成果從而兩面得利的先河,後來溫特和其他想從基因組獲利的人也很快地在定序競賽中釆取了相同做法。)比方說,法國免疫學家多塞(Jean Dausset)的做法就不太一樣。他在1980年贏得諾貝爾生理醫學獎后,獲得慷慨的贊助,得以用自己的策略來建立人類連結圖譜。他知道如果全球所有的研究人員都釆用同一組標準系譜(取自同一家族的DNA)來做的話,這個工作的完成速度將會快得多。因此,多塞在巴黎成立了人類多型性研究中心(簡稱CEPH),收集最適合用於基因分析的系譜:有三代存活於世、可以取得樣本的大家族。最後CEPH收集的資料來自61個家族,其中包括許多懷特研究的摩門教家庭、南西在馬拉開波湖研究的家族,以及由約翰霍普金斯醫學院的麥庫錫克(Victor McKusick)所記錄的安曼教派(Amish)家族。CEPH讓研究人員得以自由地使用取自這些家族的DNA樣本,惟一的條件是使用者必須把他們的分析結果交給CEPH,以便整合至這個全球性的資料庫。合研公司就充分地運用了這個資源的好處。
50年前,有一次我和父親去訪問病人時,第一次看到「那種病」的病人,當地人總是用「那種病」來稱呼這個可怕的疾病。那天的情景至今仍清晰得彷彿昨日之事,在我年輕的心靈留下永難磨滅的印象,也讓我決定要以研究舞蹈症作為獻身醫學的處|女作。當時我跟父親正開車從東漢普敦前往阿默甘西特(Amagansett),在經過一片樹林時,遇到兩名背部佝僂、手腳扭曲、臉孔歪斜的婦人,我驚訝且幾近恐懼地瞪著她們,心想,這是怎麼回事?我父親停車跟她們說了幾句話,然後我們就繼續前進。我由此展開了迦瑪列式的教育,我的醫學教育也由此開端。從那一刻起,我對這種病的興趣一直沒有停止過。
在1968年時,醫界對這種病的認知僅止於下列事實:它是遺傳性的,它會殺死腦部特定區域的神經細胞,造成不可逆的病程。米爾頓決定向這個使他全家陷於恐懼的疾病挑戰:他成立了遺傳疾病基金會(Hereditary Disease Foundation, HDF),募集資金,並且要求政府提撥更多經費來支持亨廷頓氏症的研究。他的女兒南西也投入這份工作,她在密歇根大學拿到心理學博士學位后(她的博士論文是研究可能患病者的心理狀態),逐漸深入基金會的事務。20世紀70年代,在發現惟有深入了解這種病的遺傳原理,才會有真正的進展時,南西開始朝成為遺傳學家的路邁進。
長久以來,美國肌肉蔞縮症協會,以及歐洲的類似組織,一直都很支持以了解DMD基本生化知識為主要目標的實驗研究。在20世紀70年代晚期,細胞遺傳學家(他們用顯微鏡研究染色體)提供了第一條遺傳線索。他們在一小群罹患DMD的女童身上發現,她們的一條X性染色體短臂上,標號Xp21的位置有異常現象。這有沒有可能是DMD基因的位置?
昆克爾的方法成為現代利用基因圖譜來剖析疾病的典型做法。雖然現今這已是很常見的做法,但是在昆克爾的時代,這遠遠超出傳統研究方法的範圍,而美國肌肉萎縮症協會也是以孤注一擲的賭博心態,贊助了他的研究計劃四年但他們的回收相當豐厚。先前我們只能利用生化方法來分析一個疾病的癥狀,試圖找出這個疾病的基因;但是在昆克爾之後,我們可以製作這個基因的圖譜,然後根據這個基因的功能來解釋癥狀。
複合基因病(complex disorder),亦即多基因病(polygenic disorder)則普遍得多,其中包括許多最常見的疾病:哮喘、精神分裂症、憂鬱症、先天性心臟病、高血壓、糖尿病和癌症。這些疾病是由數個(或許是許多個)基因的相互作用所引起的,但這些基因的個別影響則很小,或許根本沒有可察覺到的影響。一般而言,多基因病的問題更麻煩:這些互相作用的基因可能會造成容易罹患某種疾病的體質,但一個人是否真的會發病則取決於環境因素。假設你有一組基因變異,造成你有容易酗酒的體質,但你是否真的會酗酒在於你接觸到的環境誘因,也就是酒。如果你在得州一個禁酒的郡長大,可能會跟在紐約市中心曼哈頓長大有截然不同的命運。同樣的原則也適用於哮喘:即使在遺傳上你有容易哮喘的體質,似是在「良好」的夏天,花粉和孢子的數量少時,你可能不會有任何癥狀。
在DNA定序時代,我們不再需要看得到的遺傳標誌,例如果蠅的白眼;只要有序列本身的變異就已足夠,而且我們只要分析數代的DNA,就可以沿家譜追蹤這類的DNA標誌(也就是通過一些遺傳雜交來追蹤)。在南西開始系譜研究的前一年,這場科學革命就已經展開。而且如同許多科學進展,這多少也跟運氣有關。
這是遺傳疾病基金會研究團隊的所有實驗室辛苦努力的成果,而且為了表示這真的是協力合作的成就,在論文的作者位置只有「亨廷頓氏症聯合研究團隊」一個名稱。當時已發現同樣類型的奇特突變(三個鹼基對的序列發生重複)也與另外三種疾病有關,令人驚奇的是,它們全都是神經方面的疾病。我們現在已經知道14種這類「三核苷酸重複序列型疾病」(trinucleotide repeat disorder),但是至今我們仍不清楚為什麼腦細胞這麼容易受這類型突變的影響。
讓他們倆眼睛為之一亮的DNA標誌,即是我們在前一章中提到過的「限制酶切割片段長度九九藏書多型性」(RFLP)。當某個個體內由特殊限制酶切斷的DNA序列,在另一個體內發生變化,以至於無法再由相同的限制酶切斷時,即成為RFLP。(如前幾章所述,限制酶只能剪斷特定的序列,例如EaoRl限制酶只有在遇到GAATTC時才會切斷DNA。這個序列發生在基因組的特定位置,但在突變后,有些個體的這段序列可能發生變異,例如變成GAAGTC。限制酶只能切斷沒有改變的原序列,無法切斷髮生變化后的序列。)這些是在DNA序列里自然發生的差異,而且最常發生在垃圾DNA中,因此不具任何作用。事實上,在我們的基因組中散布著數百萬個RFLP。在阿爾他研習營后數個月,波茲坦、戴維斯、斯科尼克,以及當時在馬薩諸塞大學的懷特,開始一起研究RFLP的想法。1980年,他們共同發表了一篇劃時代的論文,預示分子人類遺傳學新時代的來臨。他們規劃出一個明確的計劃,說明RFLP可能的運用方式。他們解決了數學上的問題,找出了需要多少個RFLP才能確保人類基因組的每一點至少都在一個RFLP標誌鄰近的合理範圍內——原則上,這些條件可以幫我們繪出整個基因組圖譜。這就像在北美地圖上標出足夠數量的美國城市,然後只須利用某個未標示地點跟這些已標示城市的遠近信息,便能相當準確地找出這個未標示地點的位置。但是就基因圖譜而言,何謂「合理」範圍?波茲坦等人估計,只要有150個均勻散布在整個人類基因組中的RFLP就夠了。這個方法最直接的優點在於提供了辨識致病基因的新策略。他們可以從已有數代子孫罹患某種疾病的家族中取得患病和未患病者的DNA樣本,然後利用重組法——測試RFLP,尋找可以追蹤這個家族患病軌跡的那些RFLP。
後來,最先成功的是多倫多的研究小組。他們在1985年首度發現合研公司提供的RFLP之一和纖維囊泡症基因之間的連結。當時還不知道這個RFLP的位置,但是合研認為它具有金礦般的潛力,立刻展開搜尋。他們很快確認它位於第7號染色體上,但是沒有立即通知跟他們合作的徐立之。他們在素負聲望的《科學》雜誌11月22日刊上公布這個發現時,也沒有提及它位於哪個染色體。合研顯然想獨佔這個新信息,但是在科學界是無法保持秘密的,有關它位於第7號染色體上的消息很快就流傳開來。
當這些搜尋基因的「基因獵人」努力分離與亨廷頓氏症和DMD有關的基因時,另一場較安靜的革命也悄悄在臨床遺傳學家的辦公室展開。從一開始,南西和豪斯曼就知道,可連接至致病基因的RFLP不僅可以用於找出這些基因的位置,也可以用於診斷某個家族的成員是否攜帶突變基因。它們甚至可以用於篩檢未出生的胎兒。假設有一個DMD家族,其中至少一個男孩已經被診斷出有這種遺傳疾病——這個男孩相當於「指標病例」(index case),亦即最先顯露出這個家族有DMD突變存在的病例。他的母親帶有突變基因,也有另一個正常的等位基因。她的姐妹也可能攜帶有突變基因,因此她們所生的兒子都有患病的危險。現在假設這名母親再度懷了一名男孩,則這第一個兒子有50%的幾率會得病。但是在RFLP的協助下,她的醫生可以告訴她,這個胎兒出生后的命運。
搜尋與人類疾病有關的基因,大多不是大型研究機構或有魄力的企業家一肩挑起,而是由遺傳疾病基金會這類組織所主導,這類組織是那些對某種特殊遺傳疾病有切身之痛的人成立的。由於攸關摯親的福祉,這些組織然比較願意支持有風險或創新的研究,嘗試一般大學或生技公司所不敢涉足的領域。
在上海出生並在香港接受教育的徐立之(Lap-Chee Tsui),於1974年到美國讀研究生。他在研究病毒時,獲得有關分子遺傳學的知識,1981年加入加拿大學者布赫瓦爾德(Manuel Buchwald)位於多倫多的實驗室,研究纖維囊泡症。徐立之的個沉靜、和藹可親,對研究目標非常專註,充滿熱情。他打算通過RFLP連結分析追蹤纖維囊泡症的基因,於是把前兩三年的光陰都花在尋找罹患纖維囊泡症的家族上,然後才開始用他拿得到的每個RFLP,對這些家族成員的DNA進行測試。但是他的運氣沒有尋找亨廷頓氏症基因的古塞拉好,在努力一年後,他所做的只是刪掉了一大堆無關的RFLP。他需要更多的RFLP,而當合研公司願意跟他分享他們的RFLP標誌時,他忍不住欣喜若狂。
但是解碼公司真正的檢驗不在於反覆無常的股票市場,而在於它創造的科學。不幸的是,在這方面,不公開或延後公開的商業做法使得實際的情況難以評估。我們通過媒體發布的新聞得知,解碼公司正對46種疾病進行連結分析,包括哮喘、憂鬱症、癌症、骨質疏鬆和高血壓。它已經發現23種疾病的連結標誌,而且已經分離出造成周邊血液疾病、中風和精神分裂症的基因。但是由於他們發表在科學期刊上的細節極少,所以我們有時很難分辨到底是真正的科學成果抑或是宣傳。但是解碼公司還是證明了它的確有能力作出有用的貢獻:在2002年6月,解碼公司的研究人員發表了人類基因組的新圖譜,比人類多型性研究中心(CEPH)的舊圖譜要詳細得多。此外,在發表各界期待已久的精神分裂症研究成果后,解碼公司的科學及商業前景都露出了曙光。
第一步是在肌細胞中找出這個基因所製造的蛋白質位置。在昆克爾的實驗室工作的霍夫曼(Eric Hoffman)發現,肌肉萎縮蛋白一般位於肌細胞中,就在包覆肌纖維的那層膜下方。進一步的研究發現,肌肉萎縮蛋白在構成肌細胞內部結構的蛋白質,以及橫跨細胞膜並與細胞外其他蛋白質互動的一組分子之間,扮演著重要的連接角色。細胞內部分子與細胞膜分子之間的連接,可以在肌肉收縮與放鬆時保護細胞膜。如果缺乏肌肉萎縮蛋白,細胞膜會受損,而肌肉細胞會一一死亡。我們對於肌肉萎縮蛋白已經有全新和詳盡的了解,但至今卻仍沒有治療DMD的方法,這可能很令人驚訝,但這也正是在目前的新科技中造成挫敗感的主要原因:遺傳學家已經能辨識和了解病因,但在大多數的例子中,我們仍然找不到矯正遺傳錯誤的方法。
這聽起來像是值得推行上市的產品:一種可以篩檢嚴重疾病的基因檢驗,一個幫助婦女對自己的健康作出明智決定的方法。既然如此,為什麼萬眾公司經常被指控為商業與科學結合做了最錯誤的示範?現在萬眾公司在美國擁有9項BRCA1和BRCA2的專利,2001年時,它又在歐盟獲得1項專利,紐西蘭1項,加拿大4項,澳洲2項。事實上,這家公司壟斷了這些基因,也控制著全世界使用它們的方式。萬眾公司從BRCA1和BRCA2的突變檢驗中獲利是很合理的,畢竟他們提供了寶貴的服務,而且投資了許多金錢在研發這種檢驗上。但是這家公司要賺多少錢才算合理?今天這種檢驗的費用超過2700美元。同時,萬眾公司還限制學術界的研究人員使用BRCA基因序列來研發替代性的檢驗方法。對參与學術研究計劃的病患進行DNA定序后,從中所得到與BRCA突變有關的信息也不得透露,就連病患本身都不能得知,否則就算是用在臨床診斷上,也侵害了萬眾公司的專利權。
要確定他們找對基因的惟一方法是定出其互補DNA (cDNA)的序列,並尋找導致疾病的突變。以長達6500鹼基對的區段而言,這在1989年是相當艱難的挑戰,而且整個工作必須做兩次:一次是使用纖維囊泡症患者的DNA,一次使用健康個體的DNA。最後的結果相當清楚:纖維囊泡症患者的DNA缺少由三個鹼基對構成的小區段,造成這種蛋白質中少了一個氨基酸。大約有70%的纖維囊泡症患者都是這個突變所造成的,但是在纖維囊泡症基因中找到的其他突變也會造成這個疾病。由於有害的各種變異太多,使得以DNA為主的診斷工作變得格外複雜。現在我們把焦點轉回南西·魏克斯勒、豪斯曼、古塞拉和他們的同事身上。先前曾提到,1983年他們成功地找出連結至亨廷頓氏症基因一個標號G8的RFLP。他們尋找亨廷頓氏症基因位置的速度快得驚人,看來他們大夥的運氣異常地好,但是上天很快就把這種不平衡的狀況矯正過來了。雖然他們只花了三年就找到這個基因,但是分離它以便進行深入分析的工作,卻耗費了由150位科學家組成的國際研究小組十年的時間才完成。這個基因所在的區域長達400萬鹼基對。研究亨廷頓氏症的遺傳學家辛苦地縮小著這個範圍,但是隨著基因距離愈來愈小,繪製基因圖譜的工作也日益困難。最後他們的努力卻只換來模糊的數據。這就像為了尋找紐約而從華府往波士頓走,卻在走到費城的一個十字路口時,看到路標上有兩個不同方向的箭頭都指向紐約。
不久之後,倫敦聖瑪麗醫學院的威廉森(Bob Williamson)率先運用以RFLP為主的方式,搜尋導致纖維囊泡症和DMD的基因。他的同事戴維斯(Kay Davies)導找X染色體上的RFLP,測試它們是否與DMD相連結。結果她成功了,決定性的關鍵就在於它們的位置:Xp21區,這跟先前依據DMD女病童奇特的X染色體所作的預測一樣。

從附近一座無人島拍攝的特里斯坦-達庫尼亞島:這可能是地球上有人居住的最偏遠地點。 特里斯坦-達庫尼亞島陡峭地矗立在南大西洋上,土地面積只有40平方英里。島上首度有人定居始於1816年,英國派軍駐守該島,以防法國人以該小島為基地,把遭到放逐的拿破崙從北方1200英里處的聖赫勒拿島(St. Helena)救走。後來島上的人口成長稀稀落落,有時來—些開墾者或幾名船難倖存者。根據1993年非正式的人口調查,島上只有301人。那一年,多倫多大學的一個小組來到島上,就1961年對島民所作的醫學研究進行後續調查。在1961年時,島上的休眠火山突然活躍起來,因此島上的整個人口曾疏散至英國,在那裡接受了健康檢查。當時最驚人的發現是大約半數的撤離者都有哮喘病史。
大多數的連結分析研究必須通過譜系來追蹤基因目標,而且譜系愈大愈好。但還有一種策略是研究一小群某種疾病發病率特別高的人群,而要找到比特里斯坦-達庫尼亞島(Tristan da Cunha)還少的人群,恐怕很難。
無論解碼公司的未來如何,它三管齊下,在範圍明確的人口中,結合醫學、家族譜系與遺傳等三種記錄的全面性做法,顯然具有龐大的潛力。因此,在把整個國家的人口置於基因檢視之下的做法上,解碼公司可說吾道不孤。例如,芬蘭有600萬人口,大約有35種發病率顯著的遺傳疾病,其中有些很獨特,有些只是比其他歐洲國家常見,因此芬蘭人自然會引起不少遺傳學家的興趣。其他國家也加入基因資料庫的潮流。在2002年4月,英國開始了「生物銀行」(Biobank)計劃,愛沙尼亞政府也正在推動一個類似的全國性計劃。這類大規模的人口研究最終可以協助我們追蹤基因,甚至是那些最難捉摸的基因。
在這次學術與商業界的文化衝突后,多倫多與合研公同的夥伴關係就此破裂。後來合研發現,學術界跟他們合作時會十分提防,而合研執行長弗里德(Orrie Friedman)聲稱「我們擁有第7號染色體」,這種粗魯而且不大站得住腳的說詞對情況也毫無幫助。幸好這出肥皂劇終於在1985年12月落幕,所有的研究團隊都同意分享自己的資源,以便針對211個家庭進行檢測,確定第7號染色體上RFLP與病症的連結。結果相當驚人,這些RFLP跟纖維囊泡症基因非常接近,相距在100萬鹼基對以內,這使得這些RFLP在診斷上非常有用,而這正是纖維囊泡症研究的主要目標之一。
2000年,解碼公司獲得12年的授權,可自費建立與管理冰島陝療保健資料庫,但必須繳年費給冰島政府。這個資料庫在家族譜系方面包含沒有取用限制的信息,但醫療記錄資料庫則根據「假定同意」(presumed coment)的原則來管理,取用限制比較多。所謂「假定同意」是指除非民眾主動選擇退出,否則他們的醫療健康數據將會被輸入這個資料庫。在這個資料庫里,對基因型數據的限制最嚴格,必須取得民眾的「告知同意」(informed consent)才行,所謂「告知同意」意指個人必須主動同意提供組織樣本以供取出DNA。這種做法成了爭議的焦點:雖然解碼公司採取保護捐贈者隱私的制度,批評者仍認為這是不夠的。既然一個人的DNA數據必須連結至家族譜系和醫療記錄,取樣就不是匿名的。這些來源的身份是以加密方式來隱藏,而理論上密碼有可能被破解。有關某個家族可能帶有「不良」基因的小道消息可能會傳開來,特別是在這種人口少的國家裡,這種情形有可能導致「基因歧視」。解碼公司的計劃就像一個縮影,具體呈現出許多在其他地方還只是以假設性口吻來討論的基因隱私權問題。
不久之後,在1968年時,莉歐娜的前夫,精神分析醫師米爾頓·魏克斯勒(Milton Wexler)原本要和他們的兩個女兒——26歲的愛莉絲(Alice)和23歲的南西(Nancy)——一起在洛杉磯慶祝他的60大壽,結果那天的情況卻變了調。米爾頓告訴兩個女兒,她們的母親患有亨廷頓氏舞蹈症(Huntington disease, HD),這種可怕的神經失調症會造成腦部功能發生愈來愈嚴重的退化,使患者逐漸忘掉自己與摯愛之間有關的事。他們也會無法控制自己的手腳,起初是走路受到影響,如同莉歐娜的例子,但是隨著病情惡化,病人也會發生不由自主的痙攣。當時沒有任何藥物或療法可以治療這種逐漸步入死亡的可怕疾病。
基因和環境之間複雜的相互作用在癌症上最為明顯。基本上,癌症是由數個基因發生突變所引起的遺傳疾病。每個突變會改變細胞行為中的一個要素,直到這個細胞具有惡性細胞的全部特徵。癌症突變的發生方式有兩種。有些是遺傳,我們都聽過「那是家族遺傳」的說法,有些被冠上這種頭銜的特徵不一定真的可以遺傳(打個譬喻,就像天主教信仰),但是有些種類的癌症的確是有遺傳性的。然而,由於癌症實在很常見,有時一個家族裡有兩個甚至多個與遺傳無關的病例,也並非很罕見。(因此,研究「癌症家族」的遺傳學家在決定一個癌症是否具有遺傳性時,總是採取非常嚴格的標準。)有許多癌症突變也會在日常生活中發生。酶在複製或修補基因分子的過程中所犯的錯誤,或是細胞內正常化學反應的副作用,都有可能造成DNA遭到破壞。此外,許多癌症之所以發生,是因為我們自身的愚蠢。陽光中的紫外線是有效的致突變因子,而熱愛陽光的人卻心甘情願地暴晒在陽光下;香煙能非常有效地把致癌物質直接送進人類的肺部,引起肺癌。現在已證明其他的環境因子,例如工作場所的石綿,也會助長癌症。這些例子告訴我們:DNA會自然受損,惟有靠著社會與個人作出明智的抉擇,把這個損害降到最低。
南西·魏克斯勒希望能立即以馬拉開波湖的系譜來進行連結研究,但是波玆坦和懷特認為,要用RFLP連結分析來尋找亨廷頓氏症或任何其他疾病的基因,都為時過早。他們認為還需要做許多基礎工作(例如先行找到和繪出基因標誌的位置),才能夠把這個技術用於這類特定的目標。後來,南西執意照自己的想法去做,於是雙方朝不同的方向發展:遺傳疾病基金會努力尋找亨廷頓氏症的基因,而波茲坦和懷特則致力於完成人類基因組的完整圖譜。
現在愛莉絲和南西終於了解母親的親戚為什麼會有那些令人不安的遭遇,她們也從母親身上得知這個家族的問題。她們知道自己的三個舅舅,也就是莉歐娜的三個兄弟全都早逝;而且他們在死亡前,都有臉部歪扭、走路不穩、講話模糊不清的情形。她們知道自己的外祖父,也就是莉歐娜的父親沙賓(Abraham Sabin)也是年紀輕輕就過世了,不過莉歐娜很小心,從未提到她父親在死前也有相同癥狀。這時愛莉絲和南西最終了解到自己的家族有亨廷頓氏舞蹈症。米爾頓必須承擔的可怕任務是回答一個她們立即想到的問題:她們得這種病的幾率是多少?他的回答是:50%。
這位年輕醫生靠著本身的觀察和父親及祖父的臨床筆記(祖父的原稿上有他父親的鉛筆注),在論文中精闢地描述了這種病症(後來即被稱為「亨廷頓氏舞蹈症」,現今簡稱「亨廷頓氏症」。他指出,「當未受影響的肌肉也開始出現痙攣動作時」,舞蹈症的病況會「逐漸增加,直到所有肌肉都受到影響為止」。他也描述了伴隨而生的精神退化現象:「隨著病情發展,心智多少都會受創,最後有許多人發瘋,有些人則是身心逐漸失常,直到在死亡中解脫為止。」他也認定這種病會遺傳:「當父母之一或二者皆患病時,他們中的一位或一位以上的兒女必定也會罹患這種病。這種病不會隔代遺傳,只要有一代跳過,下一代就不會再患病。」
在委內瑞拉的馬拉開波湖(Lake Maracaibo)畔,當地的村落不僅貧窮,還因亨廷頓氏症的患病率特別高而飽受折磨。若要解開這種病的遺傳秘密,這裏可以說是最佳地點。1979年,南西開始在當地收集DNA樣本,以及記錄家族病史,目的在於建立當地所有患者的家族系譜。就一般遺傳學家而言,這是一份辛苦的工作,而對身為亨廷頓氏症患者的女兒、在未來有可能發病的她來說,這份工作的意義遠不僅止於此。她在陌生的環境中,看到很熟悉的景象:這裏的人住在架高在湖水上、屋頂用鐵皮蓋成的小木屋裡,但他們走路時像喝醉酒般搖搖晃晃,就跟她遭受病魔折磨的母親一樣。自從1979年初次造訪馬拉開波湖后,她每年都會回來這裏繼續研究。跟她合作的當地居民親昵地稱她「LaCatira」,意指她有金黃色的長發。如同她的委內瑞拉籍同事奈格瑞提(Americo Negrette,他是第一個就馬拉開波湖的亨廷頓氏症患病率提出報告的科學家)所說,她把他們當成家人,每次跟他們打招呼時都「真誠自然,毫不做作,也不擺高姿態,眼裡儘是親切」。
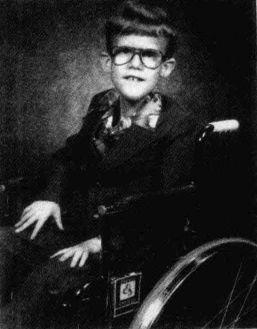
布萊爾的X染色體讓科學家得以找出DMD基因。布萊爾是一位技巧高超的風琴彈奏家,他盡量設法過正常的生活,後來於一場車禍中喪生,享年17歲。
亨廷頓氏症會對成年生活造成可怕的打擊,但是,在幼年時期就發病的遺傳疾病會讓患者幾乎沒有生存的機會,因此更加令人畏懼。在診斷確認后,我們大多能以殘酷的精確性預測病童的一生。假肥大型肌營養不良症(Duchenne muscular dystrophy, DMD)是一種進行性肌肉萎縮症,而且是一種性聯遺傳疾病:致病的突變發生在X性染色體的一個基因上。兩條X性染色陣中的有一條有這種突變的婦女,通常會因另一條X性染色體上的等位基因是正常的而不會發病。婦女同時有兩個不正常基因的幾率很小,因為帶有這種突變基因的男性幾乎部無法活到可以傳宗接代的年紀。然而,如果有突變基因的染色體傳給兒子,則這個男孩一read.99csw•com定會罹患DMD,因為他沒有另一條X性染色體來提供正常的基因複本。等到這個男孩大約5歲大時,他的父母會發現他很難站起來或爬樓悌。等到大約10歲時,他得坐輪椅,最後他可能會在快20歲或20歲出頭時死亡。DMD並不罕見,在男童的發生率為1/5000。
在他們克隆BRCA1基因時,另一個由萬眾公司和英國癌症研究中心的遺傳學家聯合組成的團隊宣布,他們在第13號人類染色體上找到第二個乳癌基因BRCA2。研究競賽再度展開,短短一年內,英國團隊就宣稱成功分離出BRCA2。他們知道一旦找到這個基因2/3的DNA序列,而且證明6個不同家族的這個序列都有缺陷,就等於獵物落網。為了不落於人後,萬眾公司組成另外一個聯合研究小組,這次是由加拿大和法國的機構所組成;他們很快就發表了完整的BRCA2序列,那是一個很長的基因。當然,萬眾公司和英國癌症研究中心都提出了專利申請。這些顯然都是在商業上很重要的基因。這些基因的突變會對婦女造成非常嚴重的後果。婦女因為擁有一份突變的BRCA1或BRCA2基因,而在70歲之前罹患癌症的幾率,有可能高達80%。此外,現在已經確定,同樣的突變也會使罹患卵巢癌的幾率提高,最高可達45%。對於家族中有突變病史的婦女,必須儘早讓她們知道自己是否帶有任何有缺陷的基因。現在已經有一些困難的但可能可以挽救性命的選擇:高危婦女可以選擇雙側乳|房切除術(bilateral mastectomy),這可以使癌症發生率降低90%。同時,基因篩檢可以找出這些家族中具有正常基因的成員,讓她們安心地知道自己的罹病率不會特別高。

基因追蹤者徐立之
在支持圖譜法的理由中,有一個最強而有力的論點是:這個方法在還沒有完全辨識出疾病基因前就可以派上用場。在搜尋亨廷頓氏症或DMD的基因時所獲得的基因標誌,在這些基因本身被找出來之前就可以用於診斷。纖維囊泡症的情形也是一樣。但是搜尋纖維囊泡症基因的研究之所以特別引人矚目,原因有二:它是首度促使私人公司尋找人類致病基因圖譜的疾病,它也是首度造成參与這類研究的科學家激烈競爭的疾病。
1979年,在這篇論文發表以前,懷特曾在冷泉港實驗室的一次會議中提出了這些構想。他特別提到「那些比較正統的分子生物學家私下有很多抱怨和不滿」。他聽到許多人對這個方法能否奏效抱持懷疑態度;即使認為這方法可行的人,也對於運用它的最佳方式看法不一。後來在一場討論如何運用RFLP連結分析來尋找亨廷頓氏症致病基因的會議上,大家開始公開提出不同的意見。
分離BRCA1基因無疑是一件大事,即使它只對一小群高危家族具有重要意義(亦即它只是少部分乳癌病例的成因),然而光是與這個基因的功能有關的知識,就足以令人興奮。金和柯林斯合作,柯林斯在尋找基因方面的資歷無懈可擊,但兩人也遇到強大的競爭。先前參与RFLP連結研究並有重大成果的猶他大學族群遺傳學家斯科尼克,跟吉爾伯特一起成立了萬眾基因公司。吉爾伯特擔任Biogen執行長時歷經的尷尬情況,並未消磨掉他的企業家精神。萬眾公司的計劃是利用摩門教家庭的家譜來繪製和克隆基因,BRCA1很快就成為他們的目標之一。1994年,由萬眾公司、猶他大學、美國國家衛生研究院、麥基爾大學(McGill University)和禮來製藥公司遺傳學家聯合組成的團隊拔得頭籌,宣布找到BRCA1基因「很有希望的候選者」,這說法算是相當客氣,因為他們的確找到了正主。參与者全都提出專利申請(雖然萬眾公司起初刻意把國家衛生研究院的科學家排除在外)。1997年,萬眾公司的申請獲得批淮。
聽起來或許有些令人沮喪,但是儘管尋找造成亨廷頓氏症、杜馨氏肌肉萎縮症和纖維囊泡症這些疾病的基因耗費許多時間,但其實以遺傳學家的標準來看,這些疾病都很「簡單」。它們是由單一基因的突變所引起的,跟環境沒什麼關係。如果你的兩份纖維囊泡症基因都缺少三個鹼基對,或是一個亨廷頓氏症基因的CAG重複數超過40個,就會罹患這些疾病,跟你的居住地點和飲食都沒有關係。目前已知有許多這種單基因病(single-gene disorder)——遺傳疾病資料庫已收錄了數千種,但它們大多極為罕見,僅出現在極少數的家族裡。
波茲坦給人的印象是「腦筋動得很快,說話也非常快,而且經常邊想邊說」。戴維斯則安靜內斂。這兩人儘管風格同異,那年4月在猶他州時,卻心有靈犀一點通。他們在聆聽猶他大學教授斯科尼克(Mark Skolnik)的研究生討論在許多摩門教家族中追蹤到的遺傳疾病時,突然同時相互對望,眼中流露出相同的頓悟。儘管他們兩人都是研究酵母的專家,但就在那一刻,他們領悟到找出人類基因位置的方法!他們發現可以利用尖端的重組DNA技術,把摩根研究果蠅的那一套遺傳分析法,套用到人類身上。事實上,當時科學家已經用DNA標誌來繪製一些其他物種的基因圖譜,但波茲坦和戴維斯日後率先開展出把這個技術運用於人類之路。這個稱為「連結分析」(linkage analysis)的技術,可以根據特定基因地標的已知位置,確定一個基因的位置。原理很簡單:如果沒有給你任何其他的信息,你很難在廣大的美國地圖上找到春田市;但是,如果我告訴你,春田市位於紐約和波士頓之間,有了這兩個地標之後,你要找到春田市就簡單得多了。連結分析就是把這個原理運用在基因上:它建立已知基因標誌和未知基因之間的關聯。這個方法用在研究果蠅基因上非常成功,但是如同先前所見,由於已知的人類基因標誌不足,這個方法一直無法用在研究人類的疾病上,直到波茲坦和戴維斯發現分子生物學的進展已經解決了這個問題為止。
波茲坦最初之所以會有悲觀的看法,原因即在於缺乏標誌:理論上RFLP很可行,但實際收集它們的工作才剛起步而已。事實上,懷特、多尼斯-凱勒和其他人要研究多年,才有可能使已知標誌的數目增加至數百個。古塞拉是在RFLP時代剛開始時就加入,這工作再適合他不過了。不過,到了1982年,他還只有12個標誌,5個是自己找的,7個是別人提供的。在此同時,南西則回到馬拉開波湖,嘗試調整她的系譜,找出誰嫁給誰,有哪些子女,誰是誰的表兄之類的關係。當地的習俗有時會成為阻礙:有些姓名相當普遍,而且許多人有一個以上的名字。南西設法建立了一個家族的家譜,上面有1.7萬個名字!她和她的同事會定期空出一整天的時間來收集血液樣本,這些樣本必須一起送往波士頓,免得馬拉開波湖的熱帶氣候加速DNA的降解。
昆克爾指導的研究生摩納柯(Tony Monaco)的任務是:如果Xp21區的DNA片段構成DMD基因的一部分,那麼他得找出究竟是哪個片段。要做到這一點,惟有拿數個沒有血緣關係的DMD患者的DNA,就每個片段——進行比對。摩納柯在第八次嘗試時終於成功:他發現有五個DMD男孩缺乏標號pERT87的序列。這意味著pERT87幾乎可以確定非常接近這個基因,甚至有可能是它的一部分。摩納柯開始分離pERT87附近的其他序列,結果證明DMD患者的DNA中也缺乏這些序列。到了1987年,昆克爾的研究小組已分離出整個DMD基因,現在它已經可以被定名為肌肉萎縮蛋白(dystrophin)了。即使在完成人類基因組序列后,肌肉萎縮蛋白仍是人類基因組中最大的基因,主要就是因為它有許多大的插入序列。
這個新知識很快就用於在產前確切診斷出DMD。科學家也很快就發現,有許多不同的突變會破壞肌肉萎縮蛋白,造成這種疾病。但當時他們仍不清楚這個基因的實際功能。了解它的功能是否能幫助我們發展出治療DMD的有效療法?
當時柯林斯已經發展出「跳躍」技術,以便於克隆一對已知RFLP之間的基因,但是他跟徐立之一樣,很清楚他們眼前的任務相當艱巨。在經過兩年的研究之後,他們設法把纖維囊泡症基因縮小至28萬鹼基對的DNA區段內,並在這個區段內發現了已知於人類汗腺中扮演重要角色的基因序列,而纖維囊泡症患者正好有汗腺功能異常的癥狀。看來要找出完整的纖維囊泡症基因,指日可侍。
亨廷頓正確地辨識出這種遺傳疾病的主要特徵。他發現男女都有可能得病,而且知道它會代代相傳。只要父母中有一方得病,每一名子女遺傳到這種病的幾率都是50%。至於誰會患病則全憑運氣,有些家庭是每一個人都患病,有些家庭完全沒有人患病。如果一名子女沒有從親代遺傳到這個異常基因,就不會把這種基因傳給下一代。今天我們已經知道亨廷頓氏症是由基因突變引起的,由於這種基因不會表現在特定性別上(亦即並非性聯遺傳),因此我們可以推論這種異常基因不是位於X或Y性染色體上。我捫可以把這個基因的正常版本稱為H,突變版本稱為h。由於我們的體染色體(autosome,即不是性染色體的染色體;亦稱常染色體)是成對的,所以我們也會有兩個成對的亨廷頓氏基因。有兩個正常基因(HH)的人可以預期不會患病,但是,擁有兩個異常基因(hh),甚至只有一個異常基因(Hh)的人則會發病。我們把這種模式稱為體染色體顯性遺傳(autosomal dominant inheritance)。
布萊爾的病例很特殊,因為他之所以得病,不是因為基因缺陷,而是因為他根本九九藏書沒有這個基因。昆克爾知道布萊爾所有的DNA在正常男孩的身上應該都找得到,而正常男孩擁有布萊爾沒有的序列就是關鍵所在。
令沙賓及其後代飽受折磨的亨廷頓氏舞蹈症,最早是由美國醫師亨廷頓(George Huntington)確認的。亨廷頓出身醫生世家,在長島的東漢普敦(East Hampton)長大,從小就跟著父親巡視病人。在哥倫比亞大學取得醫師資格后,他回到長島踵繼父業,待了幾年後才搬到俄亥俄州的波默羅依市(Pomeroy)。1872年,他在附近米德爾波特(Middleport)的米格和梅森醫學院(Meigs and Mason Academy of Medicine)發表了一篇名為《論舞蹈症》(On Chorea)的論文。自17世紀起,醫生就用源自希臘文中「舞蹈」之意的chorea來稱呼會造成痙攣動作的病。後來亨廷頓在晚年時曾經詳述他為什麼會對這種神秘的慢性病產生興趣:
1993年,「多倫多哮喘遺傳學計劃」檢查島上282名居民后,發現其中161人(佔57%)有一些哮喘癥狀。加拿大研究人員建立了當地所有家庭的家譜;這個工作並不困難,因為所有的島民都是早期15位開墾者的後代,因此他們的血統全都密切關聯。哮喘顯然是在1827年由兩位婦女帶入島上的。對基因搜尋者來說,這樣的人口用處極大:島上居民就像一個大家族,所以引起任何可以察覺之病症的基因很可能在整個人口中都一樣——這是最適合作連結分析的情況。在人數較多較為複雜的人口中,有些人的哮喘可能是一組基因所引起的,而其他一些人的哮喘則可能是另一組基因所引起的。這種異質性(heterogeneity)使我們很難找出造成複合基因病的決定因子。
過去10餘年以來,科學家也把連結分析用於其他數種癌基因上,包括與纖維神經瘤病(俗稱「象人病」,一般人並不知道這是一種癌症)、結腸直腸癌和前列腺癌有關的基因。這種一個基因一個基因來的方法儘管有效,過程卻緩慢又辛苦,而且每一個研究都得找到適當的家族來進行分析才行。在這方面,人類基因組計劃證明具有龐大的價值。本書第八章探討的DNA與蛋白質微陣列法,提供給搜尋致癌基因的獵人們一種強大的絕佳武器。我在60年代剛對癌症研究產生興趣時,我們對與癌症有關的遺傳學所知甚少,而且只能依賴很原始的工具,以至於我只能轉而研究造成動物罹患癌症的病毒,它們的基因數量很少,即使在那個年代也不難對付。當時我希望能藉由研究這類病毒,對人類的癌症深入了解。今日癌症研究已不再限於病毒,我們已經有能力繪製人類腫瘤中數萬個基因的圖譜,並克隆這些基因。在我們發現所有使正常細胞變成癌細胞的細微生化異常情況,並對細節愈發了解后,將可以獲得大量豐富的知識。
冰島的面積跟美國的肯塔基州相當,但人口只有272512人,僅有肯塔基州的1/15。維京人於9世紀10世紀到冰島定居,並在旅程中從愛爾蘭綁架婦女過來。對於積極搜尋基因的獵人們來說,冰島有數個優點。首先,冰島人口的同構型高,幾乎全部源自最早的定居者;從維京人的時代以來,外來的移民就非常少。其次,島上保存了長達許多代、詳盡的家譜記錄;許多冰島人可以追蹤祖先至500年前。除了這個有用的資源以外,冰島大學還保存了始於1840年詳細的出生記錄。最後,冰島從1914年就開始實施全國性的保健,因此整個國家的醫療記錄都經過整理,隨時可以取用——至少原則上是如此。

南西·魏克斯勒(Nancy Wexler)在委內瑞拉馬拉開波湖,抱著一位罹患早發性亨廷頓氏症的兒童。
1983年,經驗豐富的分子生物家多尼斯-凱勒(Helen Donis-Keller,當時是波茲坦的妻子)在波士頓的合作研究公司(Collaborative Research, Inc.,以下簡稱「合研」)內成立了人類基因組部門。她的目標是製作整個人類基因組的RFLP連結圖譜,上面有足夠的標誌可供找出任何染色體上的致病基因。四年後,合研公布研究成果,那篇論文有個很恰當的標題:《人類基因組的基因連結圖譜》(A Genetic Linkage Map of the Human Genome)。這個圖譜上標出了403個位置(比波茲坦最早的估計多出許多),而且計算結果顯示,人類基因組有95%都位於某個標誌的合理鄰近範圍內(或者說可合理連結至一個標誌)。對基因圖譜的製作而言,那是很重要的一天,但是到了1987年,研究人員之間再度出現分歧和競爭的情形。
萬眾公司最近作了一些讓步,他們和美國政府達成協議,凡是國家衛生研究院資助的研究計劃,都能以1400美元的特價進行這項檢驗。但是批評者仍然認為這種做法徒具象徵意義,而且批評聲浪在加拿大和歐洲特別高亢。歐洲議會通過一項決議,表達對歐洲專利局的作為感到「沮喪」,並且責成議會的工作人員就萬眾公司對這兩個基因的專利權提出抗訴。跟萬眾合作定序BRCA2的法國夥伴,對於萬眾的BRCA2專利感到格外憤怒,已向歐洲專利局提出聯合控訴。無論如何,萬眾公司的壟斷對病人恐怕都不是好事。這家公司的檢驗法並無法偵測出所有可能會影響基因的致癌變化,因此,篩檢突變的撿測結果呈陰性的人,依然有患病的危險。現在當你在接受檢測前,萬眾公司會要求你簽一份棄權書,上面說明陰性的檢驗結果並不表示在遺傳方面絕對沒有問題。光是基於技術原因,要發展出更廣泛的檢驗方法就已經很困難,但是如果沒有萬眾公司打壓研究的專利權,全球應該會有更多乳癌實驗室從事這方面的研究。
1990年,金在報告中指出,她研究了一個包括23個家庭的子群,在第17號染色體上找到一個連結至乳癌的RFLP,這個結果令醫學界相當震驚。這些家庭在三代中一共有146個乳癌病例。金檢視過可能干擾分析結果的因素,例如這些婦女可能接觸過多的X光,或是她們的懷孕史跟其他人不同,但是她的數據仍站得住腳。在染色體上代號17q2l的位置有一個基因,當這個基因發生突變時,會使婦女罹病的幾率大增。金的論文造成一股分離這個BRCA1(Breast Cancer之縮寫,亦即「乳癌1」)基因的競賽,也使基因的商業應用成為爭議不斷的話題。
由於一個人得到一個異常基因的幾率,比同時得到兩個異常基因的幾率大得多,因此大多數亨廷頓氏症患者都是Hh型。他們有可能把H或h傳給子女,造成子女有50%患病幾率,如同米爾頓給愛莉絲和南西的答案。
1974年,以研究人類與黑猩猩的關係著稱的瑪麗-克萊爾·金轉到加州大學舊金山分校,任職于研究乳癌的實驗室,決心尋找乳癌基因。當時距RFLP連結法問世還有六年,但金已經知道家族系譜中藏有線索,於是她開始搜集家族。她尋找的是曾經有年輕乳癌患者及卵巢癌患者的家族,因為她推論這些病例可能是遺傳造成的。當時她惟一可用的基因標誌是蛋白質標誌,幾年後她發表了第一篇有關乳癌的論文,描述她在測試中並未找到乳癌與任何細胞表面蛋白質的連結關係,後來她發表的一些論文也獲得類似的否定結果。反對者也同樣秉持否定態度,他們認為乳癌受環境的影響太大,無法進行遺傳分析,並預測這就像大海撈針一樣。但是金愈挫愈勇,繼續研究她的資料庫,到了1988年時,在分析了1579個家庭后,她認為自己在這些高危家族中,找到了乳癌基因的好證據。
然而,儘管有這些爭議,大多數的冰島人仍支持解碼公司,認為他們具有對抗遺傳疾病的崇高宗旨,同時可望為冰島這個小經濟體帶來大筆投資。在興奮之餘,許多冰島人自己先大筆投資在這家公司,而在解碼公司于納斯達克正式掛牌之前,它的股票就已飆升至65美元。但是經濟衰退對整體生技業來說都有不利的影響,特別是解碼公同。在本書撰寫期間,它的股票只值2美元左右。許多冰島人都後悔被當時那股「買!買!買!」的熱潮沖昏頭。然而不可否認地,解碼公司和羅氏藥廠以及默克公司(Merck)獲利極豐的合作,還是為冰島帶來大筆資金。但是隨著冰島政府提供了兩億美元的貸款保證,再加上解碼公司被迫大量裁員后,無情的現實是,解碼公司可能無法為冰島帶來原先預期的經濟繁榮。
最後分離出DMD基因的關鍵在於一位名叫布萊爾(Bruce Bryer)的男孩,他的X染色體的短臂少了一大截。由於缺少的部分實在太多,因此布萊爾除了罹患DMD以外,還有另外三種遺傳疾病。1985年,哈佛醫學院的昆克爾(Lou Kunkel)推論他可以用布萊爾的DNA,從正常男孩的DNA中「釣出」正常的基因。昆克爾利用重組法,把布萊爾的DNA從正常DNA中去除掉,留下其餘的部分,也就是應該含有DMD基因的DNA。這種減去法並非百分之百有效,但已足以讓昆克爾能夠用與Xp21區有關的基因標誌,找到想要的DNA片段。
猶他大學有個一年一度的「儀式」:每年都讓一小群研究生跟他們的指導教授一起到沃薩奇山脈(Wasatch Mountain)的阿爾塔(Alta)滑雪勝地,參加密集的研習營(順便也滑點雪)。這個研習營通常都會邀請其他學校的權威科學家參加,以批判性的眼光審視每位緊張的研究生所提出的數據。1978年,受邀參加的重要科學家包括麻省理工學院的波茲坦和斯坦福大學的戴維斯(Ron Davis)。